Определение болезни. Причины заболевания
Синдром Нельсона (Nelson's syndrome) — это редкое эндокринологическое состояние, которое характеризуется повышенной выработкой адренокортикотропного гормона (АКТГ) в гипофизе, надпочечниковой недостаточностью и гиперпигментацией кожи и слизистых оболочек [2].
Причины и факторы риска
Этот синдром можно рассматривать как осложнение двусторонней адреналэктомии (удаления обоих надпочечников) при лечении болезни Иценко — Кушинга (БИК), причиной которой стал избыток АКТГ из-за кортикотропиномы (аденомы гипофиза, вырабатывающей АКТГ).
Повышенный уровень этого гормона стимулирует надпочечники вырабатывать кортизол, поэтому при БИК он патологически повышен. Если это вызывает опасные для жизни осложнения, то оба надпочечника удаляются. После их удаления уровень кортизола резко снижается, а содержание АКТГ в ответ на это повышается ещё сильнее, что приводит к развитию синдрома Нельсона.
В большинстве случаев при синдроме Нельсона тоже обнаруживают аденому гипофиза [1][27].
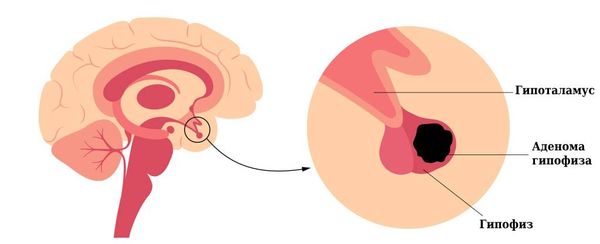
Аденома гипофиза
Основные факторы риска возникновения этого осложнения после двусторонней адреналэктомии:
- молодой возраст пациента;
- высокий уровень АКТГ в первый год после операции;
- предшествующая лучевая терапия аденомы гипофиза при БИК [6][7][8].
Значительно реже синдром становится осложнением после односторонней адреналэктомии и/или терапии специфическими противоопухолевыми препаратами, например Митотаном, также при лечении БИК [1].
Распространённость
Разные исследования показали разную частоту развития синдрома Нельсона после двусторонней адреналэктомии. Распространённость варьирует в диапазоне от 10 до 80 % и зависит от сроков наблюдения, предыдущего лечения болезни Иценко — Кушинга и возраста больного [1][3][4][5].
В России, по данным одного наблюдения, вероятность синдрома Нельсона после удаления обоих надпочечников составляет 35 % [1].
Симптомы синдрома Нельсона
Жалобы при синдроме Нельсона связаны с наличием аденомы гипофиза, которая вырабатывает большое количество АКТГ, и тяжёлой надпочечниковой недостаточности, возникшей после удаления надпочечников.
Для аденомы гипофиза и повышенного уровня АКТГ характерны:
- повышенная пигментация кожи и слизистых оболочек;
- потемнение послеоперационных рубцов, шрамов на теле и ладонных линий;
- лабильное (нестабильное) течение надпочечниковой недостаточности: частые кризы — опасные для жизни состояния, которые сопровождаются тошнотой, рвотой, низким артериальным давлением, резкой слабостью, головокружением, обмороками, судорогами и могут привести к обезвоживанию и шоку; сложности подбора заместительной терапии;
- гипогликемические состояния (т. е. связанные с низким уровнем глюкозы в крови): слабость, потливость, дрожь в руках, учащённый пульс, в тяжёлых случаях — потеря сознания);
- психологические изменения: астеническое состояние (физическая и нервно-психическая слабость), депрессивное настроение (сниженное), эмоциональная неустойчивость, тревожность, мнительность;
- неврологические проявления роста опухоли: головные боли, судороги, ухудшение зрения [1][9].
Надпочечниковая недостаточность всегда требует заместительной гормональной терапии. После двусторонней адреналэктомии пациентам назначают стероидные препараты, которые заменяют кортизол. Если надпочечниковая недостаточность скорректирована не полностью, то пациента может беспокоить целый ряд симптомов:
Патогенез синдрома Нельсона
Как работает эндокринная система
Эндокринная система — это сложный механизм, связывающий все клетки нашего организма в единое целое посредством сигнальных соединений (гормонов), которые выделяются железами и через кровь достигают своих органов-мишеней. Центральными органами в этой системе являются специальные отделы головного мозга — гипофиз и гипоталамус.
Гипоталамус регулирует работу гипофиза: подаёт ему сигналы, что надо выделять гормоны (или снизить их выработку), после этого гипофиз, вырабатывает гормоны, повышающие активность периферических отделов эндокринной системы: надпочечников, щитовидной, половых желёз и др. Например, гормон АКТГ, который вырабатывается в передней доле гипофиза, регулирует работу коры надпочечников, заставляя её вырабатывать гормоны — глюкокортикоиды (в частности, кортизол), минералкортикоиды и андрогены [11].

Влияние гипофиза на другие органы
Функции кортизола многообразны. Довольно часто это вещество называют гормоном стресса, так как он играет важную роль в адаптации организма к стрессовым факторам: инфекциям, повреждениям, эмоциональным воздействиям и т. д. Но кортизол нужен и в моменты полного покоя и благополучия, ведь он помогает поддерживать адекватное артериальное давление и обмен веществ (жиров, белков, углеводов).
Как лечение болезни Иценко — Кушинга приводит к развитию синдрома Нельсона
Одной из причин гиперкортицизма (патологического избытка кортизола) является болезнь Иценко — Кушинга. Эта патология связана с чрезмерной выработкой АКТГ в гипофизе, что обычно вызвано аденомой гипофиза (кортикотропиномой). Постоянная секреция большого количества АКТГ провоцирует надпочечники активно выделять в кровь кортизол. Из-за слишком большого количества кортизола у пациентов развивается специфическое центральное ожирение, на коже появляются акне и стрии (растяжки), нарушается работа половых желёз, повышается артериальное давление, развивается сахарный диабет, меняется настроение [13].

Симптомы болезни Иценко — Кушинга
После диагностики болезни Иценко — Кушинга врачи проводят комплексное лечение, которое включает чаще всего консервативную терапию и удаление аденомы гипофиза хирургически или с помощью лучевой терапии. Но по данным статистики, несмотря на лечение, примерно у 10 % пациентов БИК протекает крайне тяжело — с выраженными симптомами избытка кортизола. Это может быть связано с тем, что аденому невозможно удалить радикально (полностью) или возникает рецидив, т. е. аденома появляется вновь (в течение 2–4 лет рецидивы возникают в 20–25 % случаев, в том числе и поздние) [28].
Именно этим больным с тяжёлым течением для спасения жизни может выполняться двусторонняя адреналэктомия. Эта радикальная хирургическая стратегия устраняет избыток кортизола, но при этом остаётся его основная причина — прогрессирующая аденома гипофиза, которая вырабатывает АКТГ [1][29]. У части пациентов после адреналэктомии со временем может развиваться синдром Нельсона [1][13][14].
После тотальной адреналэктомии кортизол больше не вырабатывается в организме, что создаёт условия для более глубоких нарушений. В норме при большом количестве кортизола гипоталамус даёт сигнал гипофизу снизить выработку АКТГ — это так называемый принцип обратной связи. После удаления надпочечников кортизол отсутствует и не подавляет выработку АКТГ. Поэтому при синдроме Нельсона уровень АКТГ выше, чем при БИК [1].
Какие есть теории развития синдрома Нельсона
Взгляды на механизм развития синдрома Нельсона неоднородны. Есть теория, представляющая этот синдром как часть единого патологического процесса с БИК, т. е. синдром — это и осложнение, и часть основного заболевания, его определённая стадия. Рост уровня АКТГ после тотальной адреналэктомии может говорить о развитии аденомы гипофиза впервые или чаще рецидивно. У таких опухолей нет нормальных рецепторов, из-за этого нарушен механизм обратной связи, т. е. аденома не реагирует на сигналы гипоталамуса о том, что нужно снизить выработку гормона. При этом вопрос о том, обладают ли эти аденомы автономией или всё же подчиняются регулирующему воздействию гипоталамуса и центральной нервной системы остаётся открытым. Часть авторов считает, что опухоль гипофиза может развиваться уже после адреналэктомии, другие предполагают, что синдром развивается после удаления надпочечников только при наличии предшествующей аденомы гипофиза [1].
Но синдром Нельсона развивается не у всех пациентов после адреналэктомии при БИК, что позволило предположить генетические механизмы заболевания. M. Karl и соавторы считают, что высокий уровень АКТГ в крови и агрессивный опухолевый рост при синдроме Нельсона можно объяснить дефектом передачи сигналов глюкокортикоидных гормонов, поэтому проблема может быть на уровне гена глюкокортикоидного рецептора. Возможно, есть и другие предрасполагающие мутации для этого синдрома [15].
Как избыток АКТГ и аденома гипофиза влияют на организм
Параллельно с АКТГ растёт и уровень меланоцитостимулирующего (МСГ) и β-липотропного гормонов (β-ЛПГ), что вызывает гиперпигментацию. Это связано с тем, что предшественником АКТГ является крупный белок проопиомеланокортин (ПОМК), при расщеплении которого образуются АКТГ, МСГ и β-ЛПГ. Естественно, что избыток АКТГ сопровождается повышением МСГ и β-ЛПГ.
Кроме гиперпигментации, высокий АКТГ стимулирует распад жировой ткани и повышает выработку инсулина, что приводит к снижению уровня глюкозы в крови.
Из-за избытка АКТГ метаболизм глюко- и минералокортикоидов ускорен, поэтому для устранения признаков надпочечниковой недостаточности требуются более высокие дозы стероидных препаратов. Всё это приводит к нестабильному течению надпочечниковой недостаточности у этих пациентов [1].
Длительное влияние повышенного АКТГ на стероидсекретирующие клетки половых желёз может привести к развитию параовариальных опухолей (рядом с яичниками) у женщин и паратестикулярных (рядом с яичками) у мужчин.
Сама аденома в зависимости от размера и направления роста может сдавливать близлежащие зрительные и черепно-мозговые нервы, а также мозговые структуры (например, сам гипофиз) и вызывать разные офтальмологические и неврологические нарушения.
Классификация и стадии развития синдрома Нельсона
Общепринятой классификации синдрома Нельсона не существует. Можно выделить синдром с выявленной аденомой и без неё.
В зависимости от размера опухоли выделяют:
- микроаденомы — их размер до 10 мм;
- макроаденомы — более 10 мм.
Аденомы могут быть злокачественными, доброкачественными и атипичными. Чаще всего они доброкачественные, но в 0,2 % случаев бывают истинно злокачественными (карциномами). Такие опухоли предельно быстро растут и дают цереброспинальные или системные метастазы (в головной и спинной мозг, а также во внутренние органы) [16][19].
Так называемые атипичные аденомы гипофиза занимают нишу между доброкачественными и карциномами. Они тоже быстро растут и проникают в близлежащие анатомические структуры. Атипичные аденомы плохо поддаются традиционному лечению и после операции могут рано рецидивировать [19].
Осложнения синдрома Нельсона
Осложнения синдрома Нельсона связаны с высоким уровнем АКТГ и ростом аденомы гипофиза. Гиперсекреция АКТГ имеет ряд последствий для организма, часть из них можно отнести к клинической картине, а часть можно признать осложнением.
К осложнениям можно отнести развитие параовариальных опухолей у женщин и паратестикулярных у мужчин. У женщин такие опухоли вырабатывают андрогены (мужские половые гормоны), что проявляется появлением мужских черт, таких как избыточный рост волос на лице и теле, снижение голоса, развитие акне и т. д. [20] У мужчин такие опухоли гормонально не проявляются.
Рост аденомы гипофиза при синдроме Нельсона может осложняться:
1. Офтальмологическими проблемами. Сдавление перекрёста зрительных нервов (хиазмы) может серьёзно нарушать их работу, что будет проявляться снижением остроты зрения, выпадением боковых полей зрения, может развиться слепота на один или оба глаза [16].

Выпадение боковых полей зрения
2. Неврологическими проявлениями:
- При антеселлярном распространении аденомы, т. е. вниз, может нарушаться обоняние и психика.
- При параселлярном росте, т. е. вокруг турецкого седла (углубления в кости, где расположен гипофиз), возникают симптомы поражения III, IV, V и VI пар черепно-мозговых нервов (ЧМН). Проявляется это по-разному, например при поражении III пары ЧМН может возникать птоз (опущение) верхнего века.
- При супраселлярном росте (вверх) появляются общемозговые симптомы (нарушения сознания, головная боль, головокружение, рвота и др.) [17][18][26][27].
При синдроме Нельсона описаны спонтанные кровоизлияния в опухоль гипофиза, которые проявляются сильными головными болями, разнообразной неврологической симптоматикой и появлением признаков парциального (частичного) или тотального гипопитуитаризма (снижения выработки гормонов гипофиза). По данным литературы, такие состояния могут развиваться как остро, так и протекать определённое время без каких-либо проявлений [1].
Диагностика синдрома Нельсона
Синдром диагностируют только у пациентов с БИК после двусторонней адреналэктомии либо (реже) после односторонней операции и/или лечения противоопухолевым препаратом (Митотаном).
Все пациенты с БИК после удаления надпочечников находятся на учёте у эндокринолога и регулярно посещают этого врача. Именно во время таких диспансерных явок у доктора может появиться подозрение на синдром Нельсона и именно эндокринолог организует обследование пациента, чтобы подтвердить или опровергнуть диагноз.
Для диагностики важны симптомы заболевания: гиперпигментация (наблюдается у 100 % пациентов), головные боли (от них страдает до 62,5 % больных) и нарушения зрения (до 37 %) [1].
Чтобы подтвердить синдром, проводят лабораторную диагностику. Определяют уровень АКТГ. Для заболевания характерно его повышение более 200 пг/мл и отсутствие циркадианного ритма секреции, т. е. его уровень весь день одинаков, а не как в норме — утром выше, вечером ниже. По уровню АКТГ можно судить об активности процесса. При быстро увеличивающихся аденомах уровень АКТГ может достигать 3000 пг/мл и более [1].
Пациентам с подозрением на синдром Нельсона также проводят инструментальную диагностику: рентгенографию черепа, компьютерную (КТ) или магнитно-резонансную томографию гипофиза (МРТ), чтобы выявить аденому. МРТ наиболее информативно, но этот метод самый дорогостоящий и не везде доступен, поэтому чаще проводятся рентген или КТ.
Развившаяся аденома гипофиза обычно диагностируется даже на рентгенограмме и характеризуется увеличением размеров турецкого седла, выпрямлением, истончением или разрушением его стенок. При макроаденоме рентгенолог видит расширение входа в турецкое седло и укорочение клиновидных отростков. Эти признаки указывают на распространение опухоли вверх, вниз, кзади и внутрь турецкого седла [21].

Турецкое седло
В некоторых случаях диагностировать аденому гипофиза непросто, так как они часто небольшие и могут долго не нарушать структуру турецкого седла.
Дополнительно требуется консультация офтальмолога с оценкой полей зрения и состояния глазного дна. Также при выявлении аденомы больного направляют и на осмотр невролога.
Лечение синдрома Нельсона
Лечение синдрома Нельсона направлено на компенсацию хронической надпочечниковой недостаточности и снижение секреции АКТГ.
Терапия надпочечниковой недостаточности
Лечение всегда проводится с помощью стероидных гормонов: применяют минерало- и глюкокортикоиды. При синдроме Нельсона дозы для такой гормональной терапии в среднем выше, чем у других пациентов после адреналэктомии [1].
Снижение уровня АКТГ
Для снижения АКТГ комбинируют различные методики: лекарственную терапию, лучевое воздействие на аденому гипофиза и её хирургическое удаление. Динамическое наблюдение возможно у пациентов с микроаденомами, которые не сдавливают жизненно важные соседние структуры, но в этом случае требуется тщательное наблюдение, чтобы своевременно выявить прогрессирование опухоли и начать необходимое лечение [22].
Наиболее эффективная тактика — хирургическое удаление аденомы гипофиза с последующей лучевой терапией или без неё. Облучение гипофиза само по себе должно рассматриваться только у пациентов с противопоказаниями к операции [23].
Хирургическое удаление применяется при микро- и макроаденомах. Часто используется микрохирургическое вмешательство с транссфеноидальным доступом, при котором эндоскоп или инструменты вводятся в мозг через нос и клиновидную кость.
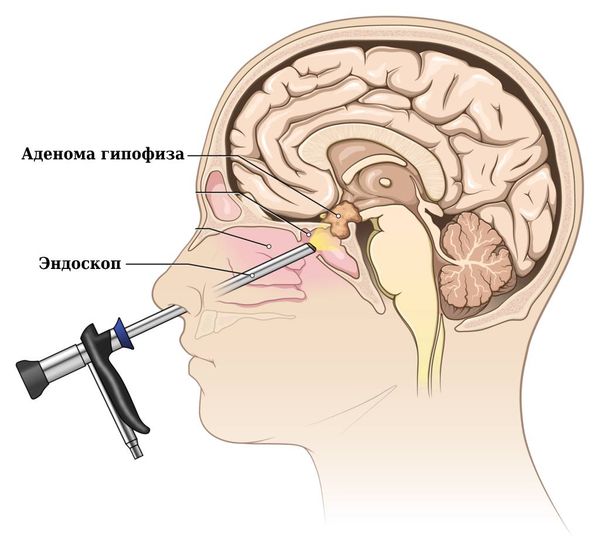
Транссфеноидальный доступ при удалении аденомы гипофиза
При макроаденомах с супраселлярным ростом (вверх) может потребоваться трансфронтальный доступ (через лобную кость). Результаты операции при небольших опухолях лучше, чем при аденомах с распространённым ростом.
После оперативного удаления может быть рецидив. В таких случаях пациентам назначают лучевую и медикаментозную терапию для его коррекции. Лучевая терапия опухоли может быть как дистанционной (протонные пучки, гамма-лучи), так и интерстициальной (введение в гипофиз радиоактивных источников, например 90It или 198Аu).
Медикаментозная терапия пока что не доказала свою эффективность при синдроме Нельсона [22]. Однако её рассматривают в тех случаях, когда другие подходы к лечению оказались неэффективными.
Для воздействия на аденому гипофиза могут применять:
- серотониновый блокатор — Ципрогептадин;
- стимулятор дофаминовой секреции — Бромокриптин;
- аналог соматостатина — Октреотид;
- препарат, подавляющий продукцию АКТГ путём усиления синтеза гамма-аминомасляной кислоты, — Вальпроат натрия [24].
Эти препараты применяются только по назначению врача и при наличии показаний, которые могут быть не у всех.
Осложнения лечения
После лучевого и оперативного лечения на гипофизе высок риск развития недостаточности эндокринных органов, которые регулируются гипофизом. К уже имеющейся надпочечниковой недостаточности может присоединиться вторичный гипотиреоз (недостаток гормонов щитовидной железы), вторичный гипогонадизм (недостаток половых гормонов), дефицит СТГ (соматотропного гормона) и несахарный диабет.
Основным осложнением хирургического лечения считается назальная ликворея — истечение прозрачной спинномозговой жидкости из одной или (реже) обеих ноздрей (встречается в 3,1–4,6 % случаев). Редко встречаются парезы (слабость) глазодвигательных нервов, зрительные расстройства, кровоизлияния в ложе удалённой опухоли и субарахноидальные кровоизлияния (в полость между паутинной и мягкой мозговыми оболочками) [28].
При развитии осложнений неврологического характера проводится реабилитация в соответствии с общими принципами реабилитации нейрохирургических больных [26].
Прогноз. Профилактика
Прогноз при синдроме Нельсона определяется агрессивностью роста аденомы гипофиза и степенью компенсации надпочечниковой недостаточности. При медленном росте опухоли и удовлетворительном лечении недостаточности надпочечников качество жизни может быть довольно высоким в течение длительного времени. Но трудоспособность почти у всех пациентов ограничена из-за тяжести надпочечниковой недостаточности и других нарушений.
Длительное наблюдение больных с синдромом Нельсона в Великобритании показало, что в первые 10 лет после постановки диагноза у 38 % пациентов заболевание прогрессировало, у 3 % аденома стала злокачественной и появились метастазы в позвоночнике, а 4 % умерли от агрессивно увеличивающейся опухоли [25].
Профилактика синдрома Нельсона
Специфической профилактики развития синдрома Нельсона после двусторонней адреналэктомии нет. Вероятно, имеет значение стабильная компенсация надпочечниковой недостаточности. Кроме того, ряд авторов рекомендуют профилактическую лучевую терапию [22].
Точно можно сказать, что после удаления надпочечников пациентам с болезнью Иценко — Кушинга необходимо регулярно наблюдаться у эндокринолога, офтальмолога и невролога, делать рентгенографию, КТ или МРТ зоны гипофиза и контролировать АКТГ [1].
Список литературы
Панькив В. И. Синдром Нельсона // МЭЖ. — 2013. — № 6. — С. 47–54.
Torres-Rios J. A., Romero-Luna G., Meraz Soto J. M. et al. Nelson's Syndrome: A Narrative Review // Cureus. — 2023. — Vol. 15, № 5.ссылка
Wright-Pascoe R., Charles C. F., Richards R. et al. A clinico-pathological study of Cushing's syndrome at the University Hospital of the West Indies and a review of the literature // West Indian Med J. — 2001. — Vol. 50, № 1. — Р. 55–61. ссылка
Cohen A. C., Goldney D. C., Danilowicz K. et al. Long-term outcome after bilateral adrenalectomy in Cushing's disease with focus on Nelson's syndrome // Arch Endocrinol Metab. — 2019. — Vol. 63, № 5. — Р. 470–477. ссылка
Palermo N. E., Ananthakrishnan S. Re-examining Nelson's syndrome // Curr Opin Endocrinol Diabetes Obes. — 2015. — Vol. 22, № 4. — Р. 313–318. ссылка
Banasiak M. J., Malek A. R. Nelson syndrome: comprehensive review of pathophysiology, diagnosis, and management // Neurosurg Focus. — 2007. — Vol. 23, № 3. — Р. E13. ссылка
Barnett A. H., Livesey J. H., Friday K. et al. Comparison of preoperative and postoperative ACTH concentrations after bilateral adrenalectomy in Cushing's disease // Clin Endocrinol (Oxf). — 1983. — Vol. 18, № 3. — Р. 301–305.ссылка
Fountas A., Karavitaki N. Management of Nelson's Syndrome // Medicina (Kaunas). — 2022. — Vol. 58, № 11. — Р. 1580.ссылка
Клиническая эндокринология: руководство / под ред. Н. Т. Старковой. — 3-е изд., перераб. и доп. — СПб.: Питер, 2002. — С. 81–88. — 576 с.
Российская ассоциация эндокринологов. Первичная хроническая надпочечниковая недостаточность: клинические рекомендации. — 2021. — 72 с.
Ермакова И. В. Современные представления о механизмах регуляции функции гипоталамо-гипофизарно-надпочечниковой системы // Новые исследования. — 2014. — № 4. — С. 77–86.
Власенко Н. Ю., Власенко М. А. Особенности циркадианного ритма кортизола человека при вынужденной депривации сна // Известия Иркутского государственного университета. Серия: Биология. Экология. — 2019. — Т. 30. — С. 105–115.
Кирилюк М. Л. Болезнь Иценко — Кушинга. Современные подходы к диагностике и лечению (клиническая лекция) // Эндокринология: Новости. Мнения. Обучение. — 2014. — № 1. — С. 54–67.
Российская ассоциация эндокринологов. Ассоциация нейрохирургов России. Болезнь Иценко — Кушинга: клинические рекомендации. — М., 2016. — 47 с.
Karl M., Von Wichert G., Kempter E. et al. Nelson's syndrome associated with a somatic frame shift mutation in the glucocorticoid receptor gene // J Clin Endocrinol Metab. — 1996. — Vol. 81, № 1. — Р. 124–129. ссылка
Assié G., Bahurel H., Bertherat J. et al. The Nelson's syndrome... revisited // Pituitary. — 2004. — Vol. 7, № 4. — Р. 209–215.ссылка
Касымханова А. Т., Бекова Д. О., Джумагалиева И. В. Офтальмологическая симптоматика при аденоме гипофиза // Нейрохирургия и неврология Казахстана. — 2009. — № 2,3. — С. 33.
Нурбекова С. Т., Крячкова А. П., Хан Д. В. и др. Аденомы гипофиза в практике врача-интерниста // Медицина и экология. — 2016. — № 3. — С. 104–111.
Пронин В. С., Анциферов М. Б., Алексеева Т. М., Пронин Е. В. Современные классификации гипофизарных нейроэндокринных опухолей // Эндокринология: Новости. Мнения. Обучение. — 2021. — № 2. — С. 48–64.
Baranetsky N. G., Zipser R. D., Goebelsmann U. et al. Adrenocorticotropin-dependent virilizing paraovarian tumors in Nelson's syndrome // J Clin Endocrinol Metab. — 1979. — Vol. 49, № 3. — Р. 381–386. ссылка
Дедов И. И., Бухман А. И., Шлыкова В. Г. Ошибки в лучевой диагностике аденом гипофиза // Проблемы эндокринологии. — 1999. — Т. 45, № 1. — С. 12–16.
Monserrate A. E., De Jesus O. Nelson Syndrome // StatPearls Publishing. — 2023.ссылка
Fountas A., Karavitaki N. Management of Nelson's Syndrome // Medicina (Kaunas). — 2022. — Vol. 58, № 11. — Р. 1580.ссылка
Марова Е. И., Арапова С. Д. Современные возможности лечения болезни Иценко — Кушинга // Эффективная фармакотерапия. Эндокринология. — 2010. — № 6. — С. 54–66.
Fountas A., Lim E. S., Drake W. M. et al. Outcomes of Patients with Nelson's Syndrome after Primary Treatment: A Multicenter Study from 13 UK Pituitary Centers // J Clin Endocrinol Metab. — 2020. — Vol. 105, № 5.ссылка
Калинин П. Л., Кадашев Б. А., Фомичев Д. В. и др. Хирургическое лечение аденом гипофиза: клинические рекомендации. — М., 2014. — 27 с.
Wilson T. A. Nelson Syndrome // Мedscape. — 2021.
Анциферов М. Б. Новые подходы к терапии болезни Иценко — Кушинга // Фарматека. — 2014. — № 16. — C. 30–36.
Nieman L. K., Biller B. M. K., Findling J. W. et. al. The Diagnosis of Cushing’s Syndrome:An Endocrine Society Clinical Practice Guideline // J Clin Endocrinol Metab. — 2008. — Vol. 93, № 5. — Р. 1526–1540.ссылка

