Определение болезни. Причины заболевания
Общий артериальный ствол (Truncus arteriosus) — это врождённый порок сердца, при котором от его основания отходит один магистральный сосуд (ствол) вместо двух. Он обеспечивает системный, лёгочный и коронарный кровоток одновременно, что не является нормой [3]. Этот единый ствол образуют аорта и лёгочная артерия из-за того, что между ними нет перегородки. Патология возникает из-за нарушения эмбриогенеза, т. е. развития плода между первым и третьим месяцем беременности.
![Общий артериальный ствол [13] Общий артериальный ствол [13]](/media/bolezny/obshchij-arterialnyj-stvol/obshiy-arterialnyy-stvol-13_s.jpeg)
Общий артериальный ствол [13]
Синонимы заболевания:
- персистирующий артериальный ствол;
- общий артериальный трункус;
- общий ствол;
- общий аортопульмональный ствол [1].
С первых дней жизни ребёнка из-за плохого кровоснабжения болезнь проявляется синюшностью кожи, учащённым неглубоким дыханием (которое усиливается при кормлении) и сердцебиением, потливостью и недостаточной прибавкой в весе [2].
Распространённость
Общий артериальный ствол (ОАС) — редкая патология сердца. Её частота среди всех случаев врождённых пороков сердца (ВПС) — от 1 до 1,7 %, среди критических ВПС — 4 % [1][2]. Этот порок развивается одинаково часто как у мальчиков, так и у девочек.
У трети больных с ОАС наблюдается нёбно-кардио-лицевой синдром (другое название — велокардиофациальный синдром). Это наследственное заболевание, при котором возникают нёбные аномалии, врождённые пороки сердца, потеря слуха, микроцефалия (недоразвитие головного мозга и черепа) и т. д. Он имеет схожие признаки с синдромом Ди Джорджи [17].
Причины и факторы риска развития порока
Причины порока точно не установлены, но известны факторы риска и механизм его формирования.
Механизм формирования
На 5–6-й неделе внутриутробного развития у плода нарушается формирование аорты и лёгочной артерии из-за неразделения примитивного ствола. Это трубка, в которую сливаются два симметричных зачатка, формирующих сердце. С ростом ствола образуется S-образная петля, она имеет две части: предсердную и желудочковую. Желудочковая часть продолжается в общий артериальный ствол, который в норме должен разделиться. Если этого не происходит, формируется общий ствол со смешанной артериальной и венозной кровью, отходящий одновременно от правого и левого желудочков.
Факторы риска:
- Сахарный диабет у матери, в том числе гестационный (возникший во время беременности), грипп и аутоиммунные заболевания при беременности.
- Хромосомные нарушения, чаще всего микроделеция 22-й хромосомы, т. е. потеря небольшого участка хромосомного материала. Из-за этого нарушения возникают велокардиофациальный синдром и синдром Ди Джорджи. Это, как правило, случайные мутации.
- Приём матерью во время беременности некоторых лекарств (например, Изотретиноина).
- Вредные привычки родителей (хронический алкоголизм матери, наркомания и курение) [1][5].
Симптомы общего артериального ствола
Так как аорта и лёгочная артерия не разделены, то в лёгкие поступает больше крови, чем должно, а в организм в целом — меньше. Из-за этого развивается выраженная сердечная недостаточность и состояние новорождённого может быть критичным с самых первых минут после рождения. Но чаще клинические проявления у ребёнка появляются в первые дни или недели после рождения.
Основные симптомы:
- выраженная одышка в состоянии покоя, которая усиливается при кормлении (это ранний и основной клинический признак порока);
- синюшность кожи;
- тахикардия (учащённое сердцебиение);
- потливость;
- недостаточная прибавка в весе [1][4].
Патогенез общего артериального ствола
В норме у эмбриона артериальный ствол ограничен сверху конусом сердца и снизу — дугой аорты. Внутри ствола возникает трункальная перегородка, которая разделяет его просвет на два канала: восходящую аорту и лёгочный ствол. Из-за сращения трункальной и конусной перегородок устанавливается связь лёгочного ствола с правым желудочком, а аорты — с левым. Левый желудочек через аорту в норме обеспечивает работу большого круга кровообращения, который отвечает за доставку крови ко всем органам и частям тела (системный кровоток). Правый желудочек через лёгочную артерию обеспечивает работу малого круга кровообращения, который отвечает за насыщение крови кислородом (лёгочный кровоток).
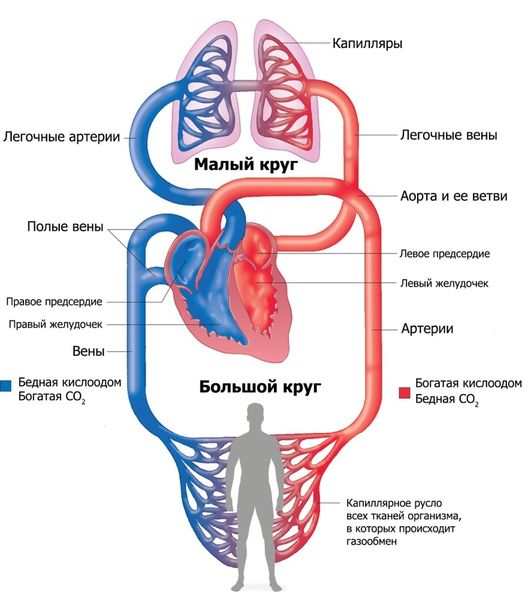
Круги кровообращения
Если трункальная перегородка не формируется, от сердца будет отходить единственный сосуд со смешанной кровью, обеспечивающий лёгочный, системный и коронарный (отвечающий за питание сердечной мышцы) кровоток. Давление в желудочках сердца, магистральном сосуде и ветвях лёгочной артерии будет одинаковым сразу после рождения, что приводит к перегрузке малого круга кровообращения [3].
В первые дни жизни лёгочный и системный кровоток работают относительно хорошо благодаря повышенному общему лёгочному сопротивлению, которое помогает двигаться крови [4]. Однако в дальнейшем сопротивление уменьшается и объём шунтируемой крови, которая сбрасывается внутрь замкнутой системы кругов кровообращения, резко повышается. Из-за этого развивается сердечная недостаточность. Она усугубляется строением полулунного клапана ОАС, который находится в основании аорты и лёгочной артерии и должен обеспечивать ток крови только в одном направлении: он слабый, полностью не смыкается и вызывает обратный ток крови [7].
При высоком давлении в лёгких и отсутствии оперативного лечения далее формируется запущенная лёгочная гипертензия (синдром Эйзенменгера) — серьёзное осложнение ОАС. В результате изменяется направление шунтирования крови, что приводит к дистрофическим изменениям сосудов малого круга кровообращения. Большой объём шунтируемой крови и плазмы (гиперволемия) при этом синдроме негативно влияет на ткани, выстилающие сосуды изнутри, вызывая на начальной стадии их гиперплазию (аномальный рост клеток) и гипертрофию (утолщение), а на поздней стадии склероз, т. е. необратимую замену нормальной функционирующей ткани на плотную соединительную ткань.
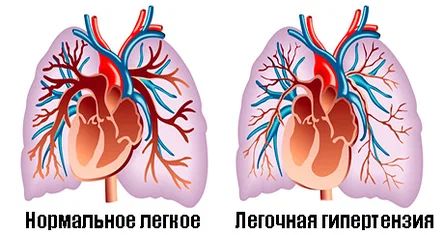
Лёгочная гипертензия
Всё это приводит к прогрессирующим симптомам: одышке во время нагрузки, утомляемости, синюшности кожи, боли в груди, непереносимости физической нагрузки и учащённому сердцебиению. Одним из более поздних проявлений бывает кровохарканье, связанное с высокой длительно существующей лёгочной гипертензией, которая может стать причиной смерти. Источником кровотечения в 90 % случаев выступают изменённые бронхиальные артерии (они относятся к малому кругу кровообращения) [3][12][13]. На поздних этапах также характерна правожелудочковая недостаточность.
Классификация и стадии развития общего артериального ствола
По Международной классификации болезней 10-го пересмотра (МКБ-10) общий артериальный ствол относится к врождённым аномалиям (порокам развития) сердечных камер и соединений.
Так как при этом заболевании повышается давление в лёгочной артерии, ему сопутствует лёгочная гипертензия, которая входит в группу других уточнённых форм лёгочно-сердечной недостаточности [1].
Авторами первой классификации общего артериального ствола в 1949 году стали В. Коллет и Дж. Э. Эдвардс. В зависимости от расположения лёгочных артерий относительно поверхности магистрального ствола они выделили 4 его типа, однако позже 4-й был из классификации удалён [1].
Сегодня выделяют 3 типа ОАС:
- Лёгочная артерия отходит от боковой поверхности общего артериального ствола и делится на правую и левую лёгочные ветви.
- Правая и левая лёгочные ветви отходят от одной из боковых поверхностей артериального ствола, а устья ветвей расположены близко друг к другу.
- Правая и левая лёгочные ветви отходят отдельно от соответствующей поверхности общего артериального ствола.
![Типы общего артериального ствола [20] Типы общего артериального ствола [20]](/media/bolezny/obshchij-arterialnyj-stvol/tipy-obshego-arterialnogo-stvola-20_s_OOg8l7i.jpeg)
Типы общего артериального ствола [20]
Чаще всего встречаются 1-й и 2-й тип порока (на них приходится около 85 % случаев) [12].
В 1965 году В. Прааг разработал классификацию общего артериального ствола в зависимости от наличия дефекта межжелудочковой перегородки. Он выделил 2 его типа:
- Тип А. Артериальный ствол с дефектом межжелудочковой перегородки.
- Тип В. Артериальный ствол без дефекта межжелудочковой перегородки [2].
Чаще всего у пациентов возникает заболевание типа А.
Осложнения общего артериального ствола
При воспалении магистральных артериол (мелких разветвлений артерий) возникают осложнения с кровообращением в лёгких, сердце и других частях тела. При этом наблюдаются:
- Затруднение дыхания. Оно возникает из-за избытка крови и плазмы в лёгких.
- Увеличение сердца. Высокое давление в лёгких провоцирует сужение в них кровеносных сосудов, из-за чего сердцу сложнее перекачивать кровь в лёгкие. В совокупности с повышенным кровотоком это вызывает перегрузку сердца, что приводит к его увеличению.
- Сердечная недостаточность. Она возникает из-за снижения кислорода в крови и колоссальной нагрузки на сердце.
Диагностика общего артериального ствола
Порок у плода можно обнаружить ещё во время беременности — на первом плановом скрининге, который проводят в период с 11-й до 16-й недели. Если его выявили и женщина решила сохранить беременность, будущей маме показано кесарево сечение в централизованном родильном доме или перинатальном центре. Во время операции рядом с ней уже должны находиться неонатолог и кардиохирург, чтобы оценить состояние новорождённого и определить дальнейшую тактику лечения. Сотрудники роддома могут вызвать скорую при таких симптомах у ребёнка, как одышка, бледность и синюшность кожи, а также обморок.
При внешнем осмотре врачи оценивают форму грудной клетки новорождённого, ощупывают область его сердца и оценивают степень синюшности кожи.
Специалисты выявляют признаки, характерные для синдрома Ди Джорджи, который часто встречается при общем артериальном стволе:
- гипертелоризм (большое расстояние между глазными яблоками);
- низко посаженные уши;
- микрогнатия (уменьшение размеров челюстей);
- двухсторонняя катаракта;
- расщепление губы или нёба;
- деформация или отсутствие ушных раковин;
- аномалия развития носа [10].
Если ОАС не диагностировали внутриутробно, то при первых признаках заболевания у ребёнка необходимо обратиться к педиатру и пройти необходимое обследование. По результатам диагностики будет понятно, нужна ли консультация кардиолога.
У новорождённых и грудных детей заметны симптомы сердечной недостаточности (например, синюшность), если у них сразу повышается объём шунтируемой крови в лёгких. При отказе от операции клиническая картина усугубляется: появляется одышка, утомляемость, кровохарканье и обмороки.
У детей старше года отмечаются признаки дефицита массы тела. Также у них возникает деформация грудной клетки в виде выпячивания грудной стенки в области сердца — так называемый сердечный горб.
![Сердечный горб [19] Сердечный горб [19]](/media/bolezny/obshchij-arterialnyj-stvol/serdechnyy-gorb-19_s.jpeg)
Сердечный горб [19]
Всем пациентам выполняется аускультация (выслушивание) сердца, что позволяет заподозрить патологию при наличии шумов в определённых точках в этой области. После проводят инструментальную и лабораторную диагностику.
Инструментальная диагностика
1. Беременным женщинам рекомендовано ультразвуковое исследование плода и дуплексное сканирование сердца и сосудов плода. С помощью этих исследований проводят первичную диагностику порока и исключают другие заболевания с похожими проявлениями.
2. Для новорождённых и детей постарше, как правило, достаточно таких исследований:
- Электрокардиография (ЭКГ). Она позволяет определить перегрузки обоих желудочков, оценки ритма и проводимости.
- Эхокардиография (ЭхоКГ). С помощью неё определяют тип порока, наличие дефектов перегородок сердца, оценивают функции клапана ствола и степени сужения лёгочных ветвей;
- Ангиография. Это рентген полостей сердца и сосудов. Исследование проводят с введением контрастного вещества через катетер и оценивают лёгочный кровоток, места отхождения лёгочных ветвей и степени их сужения. Ангиография выполняется у детей старше 6 месяцев.

Ангиография
3. Детям старше года рекомендуется проводить:
- Рентгенографию органов грудной клетки для определения формы сердца и состояния сосудов лёгких.
- Чреспищеводную эхокардиографию (ЧПЭхоКГ), когда стандартной ЭКГ недостаточно. ЧПЭхоКГ в сочетании с другими методами исследования может значительно улучшить диагностику и оценить аномалии коронарных артерий. К таким исследованиям относятся магнитно-резонансная томография (МРТ) и мультиспиральная компьютерная томография (МСКТ) с контрастированием (введением вещества для улучшения качества изображения).
- Компьютерную томографию (КТ) сердца с контрастированием для отображения эпикардиальных коронарных артерий (расположенных на поверхности сердца) и коллатералей (боковых ветвей сосудов), а также выявления паренхиматозных заболеваний лёгких. Это расстройства, которые поражают лёгочную ткань — паренхиму, отвечающую за газообмен между воздухом и кровью.
- МРТ сердца и магистральных сосудов. Она позволяет оценить структурно-функциональные изменения сердца, перегрузку его желудочков и количество шунта.
- Коронарографию. Она проводится пациентам перед коррекцией порока, если есть жалобы на боли в области сердца, для исключения риска ишемической болезни сердца [1][2].
Лабораторная диагностика
Анализы крови, как правило, нужны уже после того, как инструментально подтвердят общий артериальный ствол. Они помогают оценить эффективность лечения и состояние пациента.
К лабораторной диагностике относятся:
- Общий (клинический) анализ крови. Его проводят каждые 6–12 месяцев. Особенно в нём важен уровень гемоглобина у всех пациентов, которые принимают антигипертензивные препараты (для снижения давления) при высоком давлении в лёгких.
- Анализ на гемостаз (свёртываемость крови). Он важен, так как при пороке есть повышенный риск кровотечений и тромбозов.
- Биохимический анализ крови. Его проводят, чтобы отслеживать результаты лечения и возможные осложнения.
- Исследование иммунологического статуса. Этот анализ назначают при иммунодефиците и при подозрении на синдром Ди Джорджи.
- Анализ крови для определения кариотипа при генетических нарушениях. Его проводят при подозрении на синдром Ди Джорджи и другие генетические аномалии группы CATCH-22, синдром Дауна и синдром Эдвардса.
В качестве дополнительного исследования может быть рекомендован тест с 6-минутной ходьбой. Он позволяет оценить физическую выносливость у взрослых пациентов с пороком, осложнённым лёгочной гипертензией [1].
Пациенты с диагностированным ОАС сразу после рождения находятся под наблюдением неонатолога, детского кардиолога и кардиохирурга.
Дифференциальная диагностика
Общий артериальный ствол следует отличать от других заболеваний с похожей симптоматикой. К ним относятся:
- дефект аорто-лёгочной перегородки;
- тетрада Фалло;
- транспозиция магистральных сосудов;
- атрезия лёгочной артерии;
- комплекс Эйзенменгера [3].
Лечение общего артериального ствола
Консервативное лечение
Как правило, общий артериальный ствол лечат хирургически. Однако у новорождённых с высокими рисками осложнений при операции до хирургического лечения применяется лекарственная терапия. К причинам этих рисков относятся сопутствующие врождённые пороки сердца и/или иные отягчающие факторы, а также проявления сердечной недостаточности.
Лекарственная терапия включает препараты, которые помогают контролировать нарушения ритма сердца и поддерживать артериальное давление. К ним относятся диуретики, бета-адреноблокаторы, ингибиторы АПФ, сердечные гликозиды и кардиотонические средства [2][7]. Такое консервативное лечение касается и взрослых пациентов, потому что выраженные нарушения гемодинамики, т. е. процесса движения крови по сосудам, могут быть у пациентов любого возраста. Всё зависит от типа порока.
Хирургическое лечение
Тактика хирургической коррекции порока зависит от степени нарушения кровообращения. Операция проводится в 3–6 недель жизни ребёнка при достаточном весе, если не прогрессирует нарушение кровообращения и нет лёгочной гипертензии. Если сердечная недостаточность усиливается, несмотря на адекватную терапию, хирургическое лечение проводится, как только это становится возможным.
Операция проходит в несколько этапов:
- Отделяют лёгочные ветви от артериального ствола, полностью рассекая его поперечным разрезом.
- Если обнаружена выраженная дисфункция клапана артериального ствола, устраняют эту патологию одномоментно с коррекцией порока, проводя пластику створок клапана. Дисфункция клапана заключается в том, что при высоком давлении крови его створки не закрываются полностью, за счёт чего происходит обратный заброс крови.
- Если найден дефект межжелудочковой перегородки, его закрывают биологической или синтетической заплатой.
- Имплантируют кондуит (клапаносодержащий протез), формируя выходной отдел из правого желудочка в лёгочную артерию [1][11][12]. Кондуит — это своего рода трубка с клапаном, заменяющая полностью сосуд.
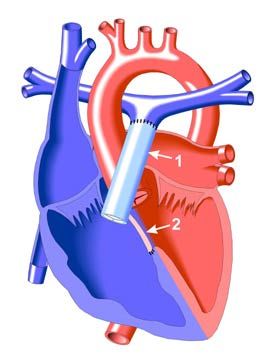
1. Кондуит 2. Закрытый заплатой дефект межжелудочковой перегородки
Оперативное лечение общего артериального ствола не рекомендуется при выраженной недостаточности кровообращения (например, при высоком лёгочном давлении и синдроме Эйзенменгера). В этом случае показана трансплантация лёгких с коррекцией порока или трансплантация комплекса «сердце — лёгкие», т. е. пересадка пациенту сердца и лёгких от донора [12].
Эндоваскулярное лечение
Это малоинвазивная операция, которая предполагает вмешательство через небольшие проколы. Она показана пациентам, если после перенесённой ранее коррекции порока возникла недостаточность или сужение кондуита. В этом случае в ходе эндоваскулярной операции его расширяют с помощью надувного баллона. Это паллиативная мера, т. е. позволяет отсрочить или избежать повторной операции для замены кондуита, которая также может проводится при этих осложнениях [1][14][15][16].
Реабилитация после операции
Если после операции возникли осложнения, в течение 6 месяцев пациент проходит реабилитацию в кардиологическом учреждении. К осложнениям относятся: лёгочная гипертензия, нарушение кровообращения, а также аритмия (нарушение сердечного ритма). Для них характерны симптомы:
- головокружение;
- учащённое сердцебиение;
- быстрая утомляемость (у маленького ребёнка первые три симптома проявляются тем, что ребёнок вялый и сонливый, отказывается от еды и теряет сознание);
- затруднение дыхания при физической нагрузке, у младенцев — при кормлении;
- отёчность живота, голеней или ступней [13].
Кроме этого, после коррекции порока может развиться инфекция или потребоваться проведение повторной операции.
Если осложнения не возникли, пациенту показана послеоперационная профилактика. Она проводится всем без исключения пациентам, чтобы оценить сердечную недостаточность, состояние гемодинамики, нарушение ритма сердца и гипоксемию (аномально низкий уровень кислорода в крови).
Профилактика включает в себя:
- Диспансерное посещение врача-кардиолога через 1, 3, 6 и 12 месяцев после операции.
- ЭКГ. Её проводят, чтобы исключить нарушения проводимости сердца (назначается всегда при диспансерном наблюдении);
- ЭхоКГ. Она позволяет оценить:
- наличие аортальной или трикуспидальной недостаточности, при которых происходит обратный ток крови во время сокращения сердца;
- наличие резидуального шунта (остаточного сброса крови после операции);
- функцию желудочков;
- лёгочную гипертензию;
- развитие подклапанного сужения аортального клапана.
- Пульсоксиметрию для оценки насыщения крови кислородом. Она проводится, если у пациента сохраняется одышка и повышенная утомляемость.
- Тест с физической нагрузкой для определения физической выносливости (при необходимости).
- Антибиотикотерапию как профилактику инфекционного воспаления перед инвазивными процедурами (проникающими в кожу и ткани) в хирургии и стоматологии (по назначению врача) [1].
- Ограничение физической нагрузки. Через 6 месяцев пациент может начать заниматься спортом при условии, что у него нет лёгочной гипертензии, нарушений ритма сердца и дисфункции сердечной мышцы [1].
Прогноз. Профилактика
При постановке диагноза во время беременности женщине рекомендуется искусственно её прервать. Ей объясняют суть патологии, её последствия без проведения операции и с хирургическим лечением, рассказывают о прогнозах и средних показателях продолжительности жизни.
Общий артериальный ствол — угрожающее жизни состояние. Смертность составляет 50 % в возрасте от 2 до 6 месяцев [4]. Более благоприятный прогноз отмечается примерно у 10 % пациентов, которые имеют различное сужение ветвей лёгочной артерии, что препятствует развитию высокого давления в лёгких [8]. Есть примеры, когда такие пациенты доживали до подросткового и более старшего возраста [6][9]. У неоперированных пациентов с незначимым нарушением кровообращения при отсутствии осложнений, таких как инфекционный эндокардит, дисфункция аортального клапана, прогноз также благоприятный [1].
Для пациентов, перенёсших хирургическую коррекцию порока сразу после рождения или в раннем младенчестве, смертность в первые дни после операции, как правило, составляет менее 10 %. У тех, кто пережил начальный послеоперационный период, выживаемость в течение 10–20 лет превышает 80 % [18].
Таким образом, если операция проведена вовремя, прогноз благоприятный. Он также зависит от функциональности анастомоза (соединения) между выходным отделом лёгочной артерии и правым желудочком и состоятельности клапана ствола. Продолжительность жизни и физическая выносливость зависят от того, насколько выражено давление в лёгочной артерии. В дальнейшем может потребоваться замена клапана или кондуита.
Профилактика общего артериального ствола
Чтобы снизить риск развития порока у ребёнка, при планировании беременности следует вести здоровый образ жизни, правильно питаться, исключить вредные привычки и приём лекарств.
Во время беременности определить порок у плода могут помочь инструментальные исследования. Для выявления наследственных заболеваний у плода, которые могут быть фактором риска развития порока, следует пройти лабораторную диагностику и получить консультацию терапевта, кардиолога и генетика.
Список литературы
Ассоциация сердечно-сосудистых хирургов России, Ассоциация детских кардиологов России. Общий артериальный ствол: клинические рекомендации. — М., 2022.
Beerman L. B. Общий артериальный ствол // MSD. — 2023.
Воробьёв А. С. Амбулаторная эхокардиография у детей. — СПб., 2009. — 561 с.
Белоконь Н. А., Подзолков В. П. Врождённые пороки сердца. — М.: Медицина, 1991. — 352 с.
Kouchoukos N. T., Blackstone E. H., Hanley F. L., Kirklin J. K. Barratt-Boyes cardiac surgery: morphology, diagnostic criteria, natural history, techniques, results, and indications. — 4th edition. — Philadelphia: Elsevier, 2013. — 354 p.
Ly R., Mousseaux E., Iserin L., Ladouceur M. Multimodality imaging before persistent truncus arteriosus repair in a 36-year-old woman // Eur Heart J Case Rep. — 2020. — Vol. 4, № 6. — P. 1–2. ссылка
Talwar S., Agarwal P., Choudhary S. K., Kothari S. S. et al. Aortopulmonary window: Morphology, diagnosis, and long-term results // J Card Surg. — 2017. — Vol. 32, № 2. — P. 138–144.ссылка
Авдеев С. Н., Горбачевский С. В., Алдашев А. А. Лёгочная гипертензия. — М.: ГЭОТАР-Медиа, 2015. — 416 с.
Горбачевский С. В., Мукимов Ф. Х., Шмальц А. А., Гренадеров М. А. и др. Эффективность двухэтапной хирургической коррекции дефекта межжелудочковой перегородки, осложнённого синдромом Эйзенменгера // Детские болезни сердца и сосудов. — 2014. — C. 1–5.
Джонс К. Л. Наследственные синдромы по Дэвиду Смиту // Атлас-справочник. — М.: Практика, 2011. — 997 c.
Brown J. W., Ruzmetov M., Okada Y., Vijay P. et al. Truncus arteriosus repair: outcomes, risk factors, reoperation and management // European Journal of Cardio-Thoracic Surgery. — 2001. — Vol. 20, № 2. — P. 221–227.ссылка
Бокерия Л. А., Шаталов К. В. Детская кардиохирургия: руководство для врачей. — М., 2016. — 864 с.
Truncus arteriosus // Mayo Clinic. — 2024.
Feltes T. F., Bacha E., Beekman R. H., Cheatham J. P. et al. Indications for cardiac catheterization and intervention in pediatric cardiac disease: a scientific statement from the American Heart Association // Circulation. — 2011. — Vol. 123, № 22. — P. 2607–2652.ссылка
Алекян Б. Г. Рентгенэндоваскулярная хирургия: национальное руководство в 4 томах // под ред. Алекяна Б. Г. — Т. 1. — М.: Литтерра, 2017. — 279 с.
Базылев В. В., Воеводин А. Б., Черногривов А. Е., Сластин Я. М. Трансвентрикулярная имплантация протеза «МедЛАБ-КТ» в позицию клапана лёгочной артерии // Грудная и сердечно-сосудистая хирургия. — 2019. — Т. 61, № 6. — С. 546–549.
Велокардиофациальный синдром // Центр молекулярной диагностики. [Электронный ресурс]. Дата обращения: 21.02.2025.
McElhinney D. B. Truncus arteriosus // Medscape. — 2019.
Regier D. S., Oetgen M., Tanpaiboon P. Mucopolysaccharidosis Type IVA // GeneReviews. — 2021.ссылка
Bhansali S., Horenstein M. S., Phoon С. Truncus Arteriosus // StartPeals. — 2024.

