Определение болезни. Причины заболевания
Внезапная сердечная смерть (sudden cardiac death) — это непредвиденная ненасильственная смерть из-за заболевания сердца, которая произошла в течение часа после появления симптомов у человека, считавшегося здоровым. Если обстоятельства смерти не зафиксированы, о внезапной смерти говорят, если погибший находился в хорошем состоянии за сутки до трагедии.
В большинстве случаев (85 %) внезапная сердечная смерть (ВСС) возникает из-за желудочковых аритмий (ЖА): желудочковой тахикардии (увеличения частоты сердечных сокращений) и фибрилляции желудочков (дрожания нижних камер сердца), приводящих к остановке сердца (асистолии).
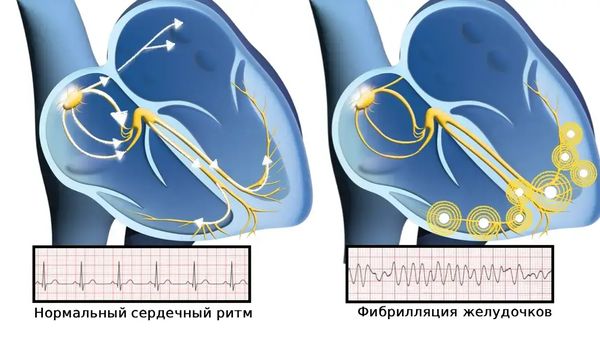
Фибрилляция желудочков — одна из причин внезапной сердечной смерти
В 15 % случаев причина ВСС — аритмии с резким замедлением сердечных сокращений (брадиаритмии), особенно в сочетании с ослаблением сократительной функции левого желудочка [3].
Диагноз «ВСС» ставится при наличии одного из следующих критериев:
- наличие у умершего врождённого или приобретённого заболевания сердца, представляющего угрозу для жизни;
- обнаружение при вскрытии патологии сердца или сосудов, ставшей причиной внезапной смерти;
- отсутствие других, не связанных с сердцем, причин смерти, а также структурных изменений сердца при микроскопическом исследовании и исключение других факторов (тогда предполагается смерть, связанная с аритмией).
Причины внезапной сердечной смерти
Наиболее частые причины у молодых людей:
- Каналопатии, или первичные электрические заболевания сердца. Это наследственные патологии с нарушением работы ионных каналов (кальция, калия и натрия) в сердечных клетках (кардиомиоцитах). Они включают:
- синдромы укороченного и удлинённого QT-интервала;
- синдром Бругада;
- катехоламин-зависимую желудочковую тахикардию (ЖТ);
- идиопатическую (с неизвестной причиной) фибрилляцию желудочков (ФЖ);
- болезнь Ленегра;
- наследственный синдром Вольфа — Паркинсона — Уайта;
- наследственную форму фибрилляции предсердий.
- Кардиомиопатии, или вторичные наследственные электрические заболевания. К ним относятся:
- гипертрофическая и дилатационная кардиомиопатии;
- аритмогенная дисплазия правого желудочка;
- изолированная некомпактность миокарда левого желудочка.
- Нарушения сердечного ритма и проводимости, которые могут возникать даже при отсутствии видимой патологии, особенно при генетических дефектах ионных каналов.
- Врождённые заболевания сердца (пороки сердца и сосудов, например аномалии развития коронарных артерий).
- Миокардиты.
- Употребление алкоголя и наркотиков, особенно в сочетании с генетическими дефектами.
- Занятия профессиональным спортом (у предрасположенных к заболеваниям сердца людей).
Наиболее частые причины у пожилых людей — хронические заболевания сердца: ишемическая болезнь сердца (ИБС), пороки клапанов, сердечная недостаточность и жизнеугрожающие аритмии [1].
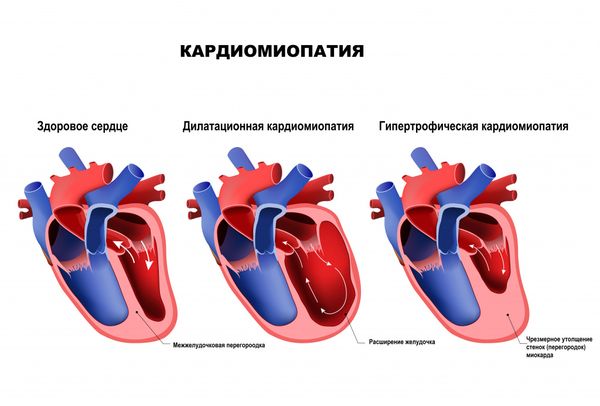
Виды кардиомиопатий
Распространённость
Ежегодно в мире от сердечно-сосудистых заболеваний умирает около 17 млн человек, и примерно четверть из них — из-за ВСС. Этот показатель особенно высок среди мужчин и увеличивается с возрастом, так как ИБС широко распространена у пожилых людей. Частота ВСС варьируется от 1,4 до 6,68 случаев на 100 тыс. человек в год среди женщин и мужчин соответственно. Среди молодёжи эта величина колеблется в пределах от 0,46 до 3,7 случаев на 100 тыс. человек ежегодно [1].
В России данные о распространённости ВСС ограничены. Исследование, проведённое в Москве в период с 2005 по 2009 год, показало, что ВСС составляет 49,1 % от всех случаев внебольничной смертности. Среди пациентов от 1 до 45 лет этот показатель достигает 27,5 %. В исследование не включались случаи смерти, вызванные травмами или тяжёлыми сопутствующими заболеваниями [1].
Факторы риска
Риск ВСС у профессиональных спортсменов составляет приблизительно 1 на 80 тыс. человек, а среди студентов, занимающихся спортом, — 1 на 50 тыс. Особенно подвержены ВСС мужчины-спортсмены, спортсмены африканского происхождения, баскетболисты в США и футболисты в Европе [4].
Симптомы внезапной сердечной смерти
ВСС может проявляться симптомами, которые требуют немедленного обращения к врачу и тщательного обследования для исключения опасных желудочковых аритмий. К ним относятся:
- Учащённое сердцебиение. При ЖТ обычно возникает и прекращается внезапно.
- Предобморочное состояние и обмороки. Могут указывать на возможные желудочковые аритмии или резкое замедление пульса (например, брадикардию), особенно во время физических нагрузок или в покое (сидя/лёжа).
- Боль в груди, одышка или быстрая утомляемость.

Сердечный ритм при брадикардии
В некоторых случаях симптомов нет до момента ВСС и она может быть первым и единственным проявлением заболевания, особенно если своевременно не оказана медицинская помощь для устранения смертельного нарушения ритма [1].
Патогенез внезапной сердечной смерти
Запустить развитие жизнеугрожающих аритмий могут:
- Стресс. Негативно влияет на работу сердца через выброс адреналина и норадреналина при наличии генетической предрасположенности.
- Физические нагрузки.
- Электролитные нарушения. Могут быть вызваны неконтролируемым приёмом мочегонных, потерей жидкости при диарее и многократной рвоте, а также высокой температуре с профузным (чрезмерным) потоотделением.
- Приём определённых медикаментов. К ним относятся препараты для лечения аритмии, психотропные и противоопухолевые лекарства, а также некоторые антибиотики при неверном их назначении и комбинации, особенно на фоне нарушений уровня электролитов (калия и магния).
- Токсическое воздействие.
- Недостаток кислорода в крови. Может быть при заболеваниях лёгких и сердца, а также анемии (уменьшении количества эритроцитов и снижении уровня гемоглобина) [3].
Чтобы понять, каким образом аритмии приводят к ВСС, нужно объяснить, как работает сердце. Оно, как насос, обеспечивает постоянный приток крови к органам и тканям. В синоатриальном узле возникает электрический импульс, который проходит через атриовентрикулярный узел и пучок Гиса, а затем — через ветви пучка и волокна Пуркинье, вызывая сокращение кардиомиоцитов. Работа электрических импульсов нарушается из-за ЖТ или ФЖ. При развитии опасной ЖТ с большой частотой сердечных сокращений сердце не успевает наполниться кровью и в результате сильно снижается кровоснабжение жизненно важных органов, и прежде всего головного мозга. Недостаток кровоснабжения приводит к острой сердечной недостаточности и остановке сердца, если пациенту не будет оказана медицинская помощь.
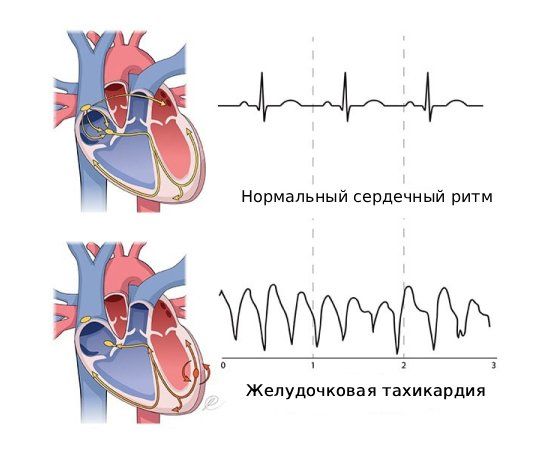
Желудочковая тахикардия
После остановки сердца кровообращение прекращается, что влечёт за собой кислородное голодание (гипоксию). [6] Головной мозг очень чувствителен к нему: потеря сознания наступает через 10–20 секунд, остановка дыхания — через 2 минуты, а клиническая смерть — через 3–5 минут. В этот период необходимо восстановить сердечную деятельность, в противном случае наступает биологическая смерть.
Классификация и стадии развития внезапной сердечной смерти
Виды ВСС:
- аритмогенная (вызванная нарушениями ритма или проводимости);
- коронарная (связанная с ИБС);
- ВСС спортсменов (гипертрофическая кардиомиопатия — частая причина гибели молодых спортсменов)[10].
Осложнения внезапной сердечной смерти
ВСС — фатальное осложнение многих заболеваний сердца. В большинстве случаев смерть наступает из-за его остановки. Если после этого ритм восстановился самопроизвольно или пациенту вовремя оказали помощь, то ВСС в диагнозе не укзывают.
Необходимо помнить, что остановка сердца может произойти внезапно у внешне здорового человека любого возраста или пола в любое время и в любом месте.
4 из 5 случаев прекращения работы сердца происходят дома, и более 90 % людей умирают до того, как их успевают доставить в больницу. Время между остановкой сердца и оказанием медицинской помощи принципиально важно, и сокращение этого времени может снизить риск смерти и инвалидности [10].
Диагностика внезапной сердечной смерти
Диагностика болезней, которые могут привести к ВСС, начинается со сбора семейного анамнеза (истории жизни и болезни), который имеет первостепенное значение, поскольку позволяет определить риски и вовремя начать обследование. Для оценки ритма, проводимости, а также структурных заболеваний сердца пациенту могут назначить инструментальные и лабораторные исследования:
- Электрокардиографию (ЭКГ) в 12 отведениях. С её помощью можно заподозрить наследственные заболевания, при которых встречается ЖА и ВСС (например, синдром укороченного или удлинённого интервала QT, синдром Бругада, гипертрофическую или аритмогенную кардиомиопатию). Исследование также позволяет обнаружить блокаду ножек пучка Гиса, которая нарушает проведение электрических импульсов в желудочках, или АВ-блокаду, которая нарушает проведение электрических импульсов от предсердий к желудочкам.
- ЭКГ с физической нагрузкой. Применяется для выявления ИБС и рисков возникновения опасных аритмий во время нагрузки.
- Холтеровское мониторирование ЭКГ (ХМЭКГ). Это метод непрерывной записи электрической активности сердца, которое может длиться от суток до недели. Позволяет установить связь между симптомами и нарушениями ритма и проводимости.

Холтеровское мониторирование ЭКГ
- Петлевые регистраторы событий. Это имплантируемые под кожу устройства, которые непрерывно контролируют сердечный ритм и регистрируют изменения в течение нескольких лет, активируясь по инициативе человека или автоматически. Обычно они используются при редких симптомах и позволяют пациенту в моменты жалоб самостоятельно записывать ЭКГ. Показаны при подозрении на серьёзные тахикардии и брадиаритмии, особенно при обмороках.
- Эхокардиография (ЭхоКГ). Наиболее распространённый метод визуализации сердца, позволяющий диагностировать заболевания сердечной мышцы, клапанов и врождённые пороки, предрасполагающие к ЖА и ВСС. Рекомендована всем пациентам с болезнями сердца и родственникам с наследственными заболеваниями, связанными с высоким риском ВСС.

ЭхоКГ
- ЭхоКГ с нагрузкой (стресс-ЭхоКГ). Применяется для диагностики ишемии миокарда (недостатка кислорода в сердце) при ИБС, когда стандартная ЭКГ в покое не даёт достаточной информации.
- Перфузионная однофотонная эмиссионная компьютерная томография (ОФЭКТ) миокарда. Во время этой процедуры в организм вводится радиофармпрепарат, который распределяется в миокарде в зависимости от кровотока. Это альтернатива стресс-ЭхоКГ, если её невозможно провести.
- Магнитно-резонансная томография (МРТ) сердца. Обеспечивает высококачественные изображения, позволяя оценить объёмы камер сердечной мышцы, массу левого желудочка (ЛЖ) и его функцию, особенно при подозрении на кардиомиопатию.
- Мультиспиральная компьютерная томография (МСКТ). Позволяет определить массу миокарда ЛЖ, объём и рассчитать фракцию выброса (процент крови, который желудочек выбрасывает во время каждого сокращения). Результаты исследования такие же надёжные, как и при МРТ. Введение контрастного вещества при МСКТ также позволяет оценить коронарные артерии.
- Коронарография. Важна для диагностики ИБС, позволяет подтвердить или исключить значительные сужения коронарных артерий у пациентов с ЖА, угрожающими жизни, и у переживших ВСС.
- Электрофизиологическое исследование (ЭФИ). Определяет первопричину обморока, возникающего во время серьёзной аритмии, и позволяет определить необходимость имплантации кардиовертера-дефибриллятора [1].
- Тест с наклонным столом (Tilt-test). Этот метод диагностики выявляет причины внезапных обмороков. В ходе него пациента переводят из горизонтального положения в вертикальное и обратно на специальном поворотном столе, оценивая снижение артериального давления и/или частоты сердечных сокращений и потерю сознания.
- Генетический анализ на мутации. Показан всем пациентам, имеющим клинические проявления желудочковых нарушений ритма, отягощённый семейный анамнез и при наличии изменений на ЭКГ или ХМЭКГ (например, при удлинении интервала QT более 500 м/сек без других причин удлинения) [2].
ВСС подтверждается при следующих признаках:
- отсутствие сознания и пульса на сонных артериях у взрослых или плечевой артерии (у детей до года);
- прекращение дыхания.
Эти признаки указывают на клиническую смерть — потенциально обратимый процесс, при котором перестают эффективно работать дыхание и кровообращение, но головной мозг ещё сохраняет способность к выживанию. При проведении сердечно-лёгочной реанимации (СЛР) в течение первых 5–7 минут пациента можно вернуть к жизни без повреждений мозга. СЛР всегда начинают на месте возникновения клинической смерти и не прекращают до возвращения самостоятельного дыхания и работы сердца.
Тактика проведения реанимации зависит от времени, прошедшего с момента остановки кровообращения, и возможности дефибрилляции (подачи электрического разряда через грудную клетку для восстановления нормального сердечного ритма).
Если реанимация проводится в больнице, то ЭКГ позволяет отличить ФЖ, которая требует немедленной дефибрилляции, от асистолии или электромеханической диссоциации (когда сердце не создаёт эффективного кровотока и пульс не определяется), при которых дефибрилляция не показана. При невозможности экстренно записать ЭКГ оценивают признаки остановки кровообращения и реакции на СЛР.
Если реанимация не помогла, то наступает биологическая смерть — посмертные изменения во всех органах и системах, которые носят необратимый характер.
Посмертное исследование и молекулярно-генетический анализ важны не только для установления причины ВСС, но и для будущего обследования и генетического тестирования родственников [5].
Лечение внезапной сердечной смерти
Лечение и профилактика ВСС начинаются с диагностики и стабилизации основного заболевания сердца. Например, при сердечной недостаточности основой профилактики ВСС являются препараты, защищающие сердце (бета-блокаторы, антагонисты альдостерона, Валсартан + Сакубитрил, ингибиторы НГЛТ-2) [3].
Важно также контролировать течение сопутствующих болезней, таких как заболевания лёгких, сахарный диабет, ожирение, дислипидемия и анемия.
Лечение обнаруженной аритмии включает:
1. Отмену и замену препаратов, которые могут вызывать аритмию, т. е. обладают аритмогенным побочным действием.
Препараты, которые могут вызвать аритмию
2. Медикаментозную противоаритмическую терапию. У пациентов без выявленной структурной патологии сердца лечение ЖА не проводится, так как у них низкий риск ВСС. Терапия назначается, если аритмия вызывает симптомы, приводит к расширению сердца и снижению его сократимости или превышает 15 % от общего количества сердечных сокращений в сутки (по данным мониторирования) [2].
2. Катетерную абляцию очага аритмии. Особенно она эффективна при ЖА. Метод основан на разрушении патологического участка сердца с использованием радиочастотной абляции (РЧА), при которой высокочастотный ток через катетер нагревает и блокирует этот участок. Иногда используют другие методы: криотермию, т. е. воздействие низких температур, лазерную энергию и внутрисосудистое введение алкоголя. Любое оперативное лечение, даже с минимальным вмешательством, может иметь осложнения, которые связаны с особенностями лечения, состоянием пациента и опытом хирурга. Осложнения радиочастотной абляции возникают нечасто. Иногда наблюдаются гематомы в месте введения катетера, тромбоз глубоких вен, перфорации артерий (разрыв стенки сосуда) и пневмоторакс (скопление воздуха между лёгким и плеврой). Возможны спазм и тромбоз коронарных артерий, повреждение сердечных клапанов и водителей ритма, т. е. специализированных клеток проводящей системы сердца. Минимизировать эти осложнения можно при тщательном отборе пациентов для процедуры, качественной подготовке и проведении абляции в учреждениях с большим опытом такого лечения.
3. Имплантацию кардиовертера-дефибриллятора. Его установка возможна в следующих случаях:
- пациент страдает гипертрофической кардиомиопатией, каналопатией или другими заболеваниями, которые могут вызвать ЖТ или ФЖ;
- пациент перенёс инфаркт миокарда, или у него диагностированы жизнеугрожающие аритмии, не поддающиеся антиаритмической терапии.
Важно учитывать возможные осложнения, такие как инфекции, ложные шоки (неадекватные шоковые разряды) и отказы устройства. Их возможно предотвратить, если вовремя проходить тестирования устройства — обычно не реже раза в год, а также обращаться при первых негативных симптомах к врачу и не нарушать условий эксплуатации аппарата [7].
Неотложная помощь при внезапной сердечной смерти
Внезапная остановка кровообращения, приводящая к ВСС, характеризуется внезапной потерей сознания, остановкой дыхания, отсутствием сердечной деятельности и артериального давления. Без своевременной помощи в течение 5–7 минут наступает биологическая смерть. Однако немедленные действия могут значительно повысить шансы на выживание.
При подозрении на остановку кровообращения у человека необходимо:
- Оценить его состояние: определить, находится ли он в сознании, проверить цвет кожи (бледная или синюшная). Если человек не в обмороке, уточнить жалобы на боль в груди и одышку.
- Вызвать скорую помощь ещё до того, как у пострадавшего остановится кровообращение, что повысит его шансы выжить.
- Крайне важно немедленно вызвать реанимационную бригаду и начать СЛР, если сердце уже остановилось. СЛР может увеличить шансы на выживание после остановки сердца в 2–4 раза.
- Использовать дефибриллятор при возможности. Дефибрилляция в течение 3–5 минут с момента внезапной остановки кровообращения повышает выживаемость до 50–70 %, поэтому автоматические наружные дефибрилляторы в общественных местах значительно увеличивают шансы на спасение жизней [12].
Прогноз. Профилактика
На благоприятный исход ВСС будет влиять скорость диагностики жизнеугрожающих аритмий, своевременное начало лечебных мероприятий и продолжительность остановки кровообращения.
При генетически обусловленных ФЖ факторы риска ВСС изучены недостаточно. Для многих каналопатий и кардиомиопатий не разработаны эффективные методы определения риска [6].
Профилактика внезапной сердечной смерти
Мероприятия, направленные на профилактику ВСС, делятся на следующие виды:
- Первичные. Подразумевают профилактику у пациентов, не перенёсших ВСС, но имеющих риски.
- Вторичные. Профилактика направлена на снижение риска повторных эпизодов внезапной остановки кровообращения и тяжёлых ЖА, если их причина не была обратимой, например не была связана с нарушением баланса электролитов или отравлением лекарством [8].
Для оценки факторов риска ВСС применяются следующие методы:
- ЭКГ оценивает продолжительность интервала QT, которая может указать на риск желудочковых аритмий при синдроме укороченного и удлинённого интервала QT. ЭКГ в 12 отведениях проводится при диспансеризации: для мужчин старше 35 лет и женщин старше 45 лет — каждые 3 года, для пациентов моложе — при первичном обследовании. У детей ЭКГ проводят при профилактических осмотрах в возрасте 1, 7, 10, 14–17 лет, а также перед поступлением в средние и высшие учебные заведения [1].
- На ЭхоКГ определяется степень утолщения межжелудочковой перегородки при гипертрофической кардиомиопатии. В частности, у пациентов с гипертрофической кардиомиопатией необходимо оценивать 5-летний риск ВСС при первичном обследовании и переоценивать его через 1–2 года и при изменении состоянии здоровья.
- Шкала HCM Risk-SCD прогнозирует вероятность внезапной смерти в течение 5 лет у пациентов старше 16 лет, у которых не было реанимации после эпизодов ЖТ с потерей сознания или гемодинамическими нарушениями (патологиями системы кровообращения).
- Молекулярно-генетические исследования помогают оценить риск ВСС, но их значимость подтверждена лишь для некоторых генетических заболеваний: синдрома удлинённого интервала QT и дилатационной кардиомиопатии.
При таких заболеваниях, как синдром Бругада и синдром укороченного интервала QT, вопросы имплантации кардиовертера-дефибриллятора остаются открытыми, так как нет точных данных, как установка аппарата повлияет на прогноз у пациентов с этими генетическими заболеваниями [9].
При обследовании спортсменов перед допуском к тренировкам врач должен собрать подробную информацию о случаях ВСС и заболеваний сердечно-сосудистой системы в семье, а также назначить ЭКГ с последующим углублённым обследованием при выявлении отклонений [4].
Список литературы
Голицын С. П., Костюкевич М. В., Лайович Л. Ю., Миронов Н. Ю. и др. Евразийские клинические рекомендации по диагностике и лечению желудочковых нарушений ритма сердца и профилактике внезапной сердечной смерти // Евразийский кардиологический журнал. — 2022. — № 4. — С. 6–67.
Лебедев Д. С., Михайлов Е. Н., Неминущий Н. М., Голухова Е. З. и др. Желудочковые нарушения ритма. Желудочковые тахикардии и внезапная сердечная смерть. Клинические рекомендации 2020 // Российский кардиологический журнал. — 2021. — Т. 26, № 7. — С. 128–189.
Шляхто Е. В., Арутюнов Г. П., Беленков Ю. Н. Национальные рекомендации по определению риска и профилактике внезапной сердечной смерти. — М., 2013. — 167 с.
Pelliccia A., Sharma S., Gati S., Bäck M. и др. Рекомендации ESC по спортивной кардиологии и физическим тренировкам у пациентов с сердечно-сосудистыми заболеваниями // Российский кардиологический журнал. — 2021. — Т. 26, № 5. — С. 335–407.
Ревишвили А. Ш., Неминущий Н. М., Баталов Р. Е., Гиляров М. Ю. и др. Всероссийские клинические рекомендации по контролю над риском внезапной остановки сердца и внезапной сердечной смерти, профилактике и оказанию первой помощи // Вестник аритмологии. — 2017. — № 89. — С. 3–104.
Osman J., Tan S. C., Lee P. Y., Low T. Y. et al. Sudden Cardiac Death (SCD) — Risk Stratification and Prediction with Molecular Biomarkers // Journal of Biomedical Science. — 2019. — Vol. 26, № 1. ссылка
Талибуллин И. В., Лебедева Н. Б. Имплантируемые кардиовертеры-дефибрилляторы в профилактике внезапной сердечной смерти: современные рекомендации по применению и реальная клиническая практика (обзор литературы) // Бюллетень Сибирской медицины. — 2022. — Т. 21, № 1. — С. 183–196.
Бойцов С. А., Давтян К. В., Зенин С. А., Кузнецов В. А. и др. Клинические рекомендации по проведению электрофизиологических исследований, катетерной абляции и применению имплантируемых антиаритмических устройств. — 2017. — 702 с.
Российское кардиологическое общество. Гипертрофическая кардиомиопатия: клинические рекомендации. — 2020. — 151 с.
Graham R., Margaret A., Schultz A. M. Strategies to Improve Cardiac Arrest Survival: A Time to Act. — Washington: The National Academies Press, 2015. — 438 p.
Школьникова М. А., Харлап М. С., Ильдарова Р. А. Генетически детерминированные нарушения ритма сердца // Российский кардиологический журнал. — 2011. — Т. 87, № 1. — С. 8–25.
Soar J., Böttiger B. W., Carli P., Kouper K. Рекомендации Европейского совета по реанимации 2021: Расширенная СЛР / пер. с англ. А. А. Науменко. — Южно-Сахалинск, 2021. — 77 с.

