Определение болезни. Причины заболевания
Опухоль Вильмса (Wilms tumor) — это высоко злокачественная эмбриональная опухоль почки, которая чаще всего встречается у детей от 2 до 7 лет [1]. Это наиболее распространённый тип рака брюшной полости у детей. Кроме того, на его долю приходится около 90 % случаев опухолей почки [12].
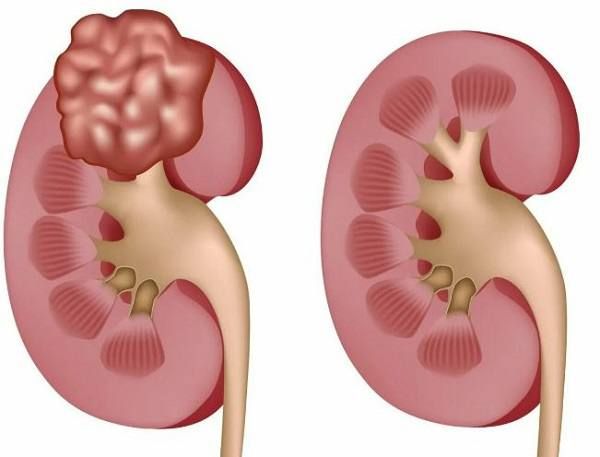
Нефробластома
Впервые эту опухоль описал немецкий хирург Макс Вильмс в 1899 году, поэтому она названа в его честь. Опухоль Вильмса также известна как нефробластома, эмбриома почки, аденомиосаркома и смешанная опухоль почки.
Иногда нефробластому находят ещё на внутриутробном этапе развития посредством ультразвукового исследования (УЗИ), поэтому существует программа периодического ультразвукового скрининга рожениц.
Распространённость опухоли Вильмса
Нефробластома занимает 4-ю строчку в структуре детских злокачественных опухолей, частота её выявления составляет от 0,7–0,8 до 1 случая на 100 тыс детей. Чаще всего смешанную опухоль Вильмса находят у малышей в возрасте от 2 до 5 лет, значительно реже — у новорождённых и как исключение — у детей старше 8 лет [2]. Среди всех описанных случаев нефробластомы лишь 3 % рассказывают о взрослых пациентах [3]. Средний возраст постановки диагноза составляет 3,5 года [13].
Девочки подвержены болезни чуть больше, чем мальчики [14]. Кроме того, существует некоторая территориальная закономерность: опухоль чаще встречается у африканцев и афроамериканцев, у жителей Восточной Азии — реже. Двусторонний опухолевый процесс составляет около 5 % от общего числа всех нефробластом у детей, чаще его наблюдают у девочек [1].
Причины развития опухоли Вильмса
Нефробластома развивается из зародышевых клеток почечной ткани и составляет около 7 % всех новообразований у детей.
Причины развития опухоли Вильмса до конца не известны, но считается, что она формируется под воздействием генетических и эмбриологических изменений мочеполового тракта. В большинстве случаев (около 60 %) нефробластома возникает вследствие соматической мутации — мутации, которая может возникнуть в любых клетках организма, кроме половых, и обычно не передаётся по наследству. Остальные 40 % опухолей Вильмса обусловлены мутациями, передающимися по наследству от родителей или ближайших родственников [4]. В этом случае считается, что возникновение нефробластомы — это результат наследования мутаций рецессивных генов-супрессоров WT1, WT2 и p53, которые находятся в 11-й хромосоме [4][7].
В ряде случаев опухоль Вильмса является проявлением наследственных синдромов, например:
- синдрома WAGR — характеризуется сочетанием нефробластомы, аномалии мочеполовых органов, аниридии (отсутствия радужной оболочки глаза) и задержки умственного развития;
- синдрома Дениса — Драша — проявляется нефропатией, опухолью Вильмса и нарушением формирования пола 46 XY;
- синдрома Беквита — Видемана — приводит к макроглоссии, омфалоцеле, висцеромегалии (увеличению печени, почек, селезёнки, поджелудочной железы и надпочечников), нефробластоме, опережению роста новорождённого и неонатальной гипогликемии [4].
К пусковым факторам относят радиационное поражение (например, при радиационной аварии или катастрофе в зоне проживания) и контакт родителей с канцерогенными веществами на вредном производстве или при проживании на экологически неблагоприятной территории [5]. Отдельным фактором риска считается возраст родителей: чем они старше, тем больше вероятность рождения ребёнка с нефробластомой [1].
Симптомы нефробластомы
На ранней стадии развития опухоли специфических симптомов нет. Сперва у малыша отмечается общее недомогание, бледность кожи и незначительное повышение температуры (от 37,1 до 38 °C). По мере роста опухоли родители могут сами её обнаружить при купании ребёнка: в брюшной области прощупывается мягко-эластическое овальное образование с гладкой или бугристой поверхностью. Кроме того, появляется асимметрия поясничной области и передней брюшной стенки (она будто выбухает).
Темпы роста опухоли различны, но чаще всего нефробластома растёт быстро, сдавливая окружающие органы и ткани. По ходу её увеличения расширяется подкожная венозная сеть так, что можно увидеть вены через кожу живота. Визуально они напоминают голову медузы. Сдавление магистральных (крупных) сосудов приводит к повышению артериального давления, появлению свободной жидкости в брюшной полости и отёку ног. На этом этапе появляется боль разной степени выраженности, при этом она не сосредоточена в одном месте. На фоне недомогания ребёнок становится плаксивым, быстро утомляется и теряет интерес к окружающему миру.
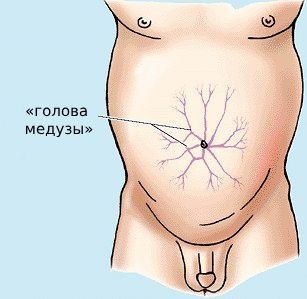
Выбухающие вены («голова медузы»)
Первичные симптомы опухоли Вильмса:
- опухоль брюшной полости, которую можно прощупать самостоятельно, наблюдается у 60 % пациентов;
- повышение артериального давления (проявляется головной болью, головокружением, снижением остроты зрения, носовыми кровотечениями, рвотой, нарушением сна и кратковременными обмороками) — 25 %;
- примесь крови в моче, видимая невооружённым глазом либо выявляемая при микроскопии мочи, — 15 %;
- тошнота, рвота, боль в животе, паховая грыжа — 8 %;
- запор — 4 %;
- немотивированное снижение веса — 4 %;
- инфекции мочевыводящих путей (сопровождаются неприятным или болезненным мочеиспусканием, резью в области наружных половых органов или частыми мочеиспусканиями малыми порциями, при этом ребёнок постоянно тянет руки к паху) — 3 %;
- жидкий стул — 3 % [8].
Из сопутствующих состояний чаще других отмечают задержку физического развития (в 11 % случаев) и врождённые пороки развития мочевыводящих путей (9 %), например значительное уменьшение и поликистоз почек, гипоспадия или крипторхизм [15].
При возникновении нефробластомы у взрослого наиболее распространённым симптомом является гематурия — обильная примесь крови в моче. Она может осложниться анемией, которая проявляется слабостью при физической активности.
Считается, что опухоль Вильмса склонна к метастазированию даже на ранних стадиях. Этот процесс зависит от биологического потенциала и характера опухоли, а также от возраста пациента (чем моложе человек, тем позже развиваются метастазы).
В целом выраженность симптомов зависит от расположения опухоли в почке, её размеров, а также наличия отдалённого метастазирования.
Патогенез нефробластомы
Двухступенчатая теория канцерогенеза, выдвинутая американским генетиком Альфредом Джорджем Кнудсоном, утверждает, что нефробластома появляется в результате мутации половой клетки и изменения эквивалентного гена в гомологичной хромосоме [4]. Простыми словами, в процессе развития организма происходит сбой в геномном материале, который запускает активный процесс деления клеток почки, что приводит к быстрому прогрессированию злокачественной опухоли.
Предпосылкой или начальной стадией опухоли Вильмса является нефробластоматоз. В 57–60 % случаев он характеризуется формированием участков недифференцированной метанефрогенной бластемы (эмбриональной структуры, дающей начало почке) в неизменённой ткани почек ребёнка, т. е. в почках остаются и разрастаются участки недоразвитой эмбриональной почечной ткани, которые имеют высокий потенциал к озлокачествлению и являются субстратом для развития нефробластомы [11].
Опухоль Вильмса представляет собой эмбриональную опухоль, которая состоит из бластных (незрелых), стромальных и эпителиальных клеток. В зависимости от того, какие клетки преобладают, выделяют тип нефробластомы, что также влияет на прогноз лечения. Чем более выражены изменения в опухолевых клетках, тем выше степень злокачественности. Наиболее интенсивная степень злокачественности наблюдается у бластемного типа опухоли.
Классификация и стадии развития нефробластомы
Практикующие врачи используют общепризнанную классификацию Национальной группы исследования опухоли Вильмса [4]. Она основана на распространённости процесса и разделяет болезнь по стадиям, которую устанавливают уже после операции:
- 1 стадия — новообразование ограничено почкой, полностью удалено без нарушения капсулы почки;
- 2 стадия — опухоль прорастает за пределы капсулы почки, но удалена полностью; возможно прорастание в рядом расположенные сосуды почки;
- 3 стадия — новообразование проросло за пределы почки и удалить его полностью невозможно, поэтому опухолевые клетки могут распространяться по брюшине или по краю операционного разреза, возможно поражение лимфатических узлов;
- 4 стадия — метастазы проникают в лёгкие, печень, кости и головной мозг;
- 5 стадия — поражены обе почки.
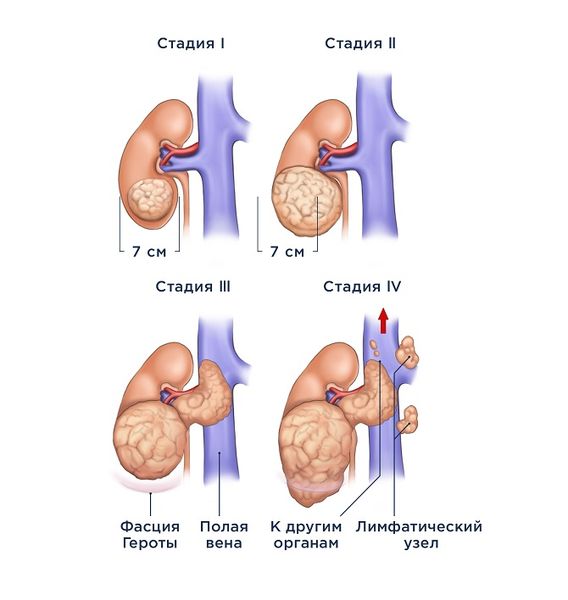
Стадии нефробластомы
По степени злокачественности и риску неблагоприятного исхода выделяют:
- нефробластомы с низкой степенью злокачественности: мезобластическая нефрома, фетальная рабдомиоматозная нефробластома, кистозная, частично дифференцированная нефробластома;
- нефробластомы со средней степенью злокачественности: нефробластома без анаплазии («классическая»), нефробластома с фокальной анаплазией (в одном из участков зрелые клетки утрачивают свои морфологические характеристики, так что определить их происхождение невозможно);
- нефробластомы с высокой степенью злокачественности: нефробластома с диффузной анаплазией, светлоклеточная саркома, рабдоидная опухоль почки [2].
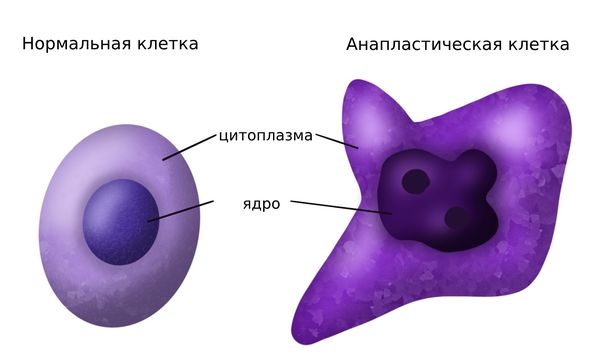
Анаплазия
Осложнения нефробластомы
В случае опухоли Вильмса возможно лимфогенное и гематогенное метастазирование, т. е. метастазы распространяются как по лимафтическим, так и по кровеносным сосудам. Прежде всего поражаются лимфоузлы вблизи почечных ворот, парааортальные лимфоузлы и лимфоузлы печени.
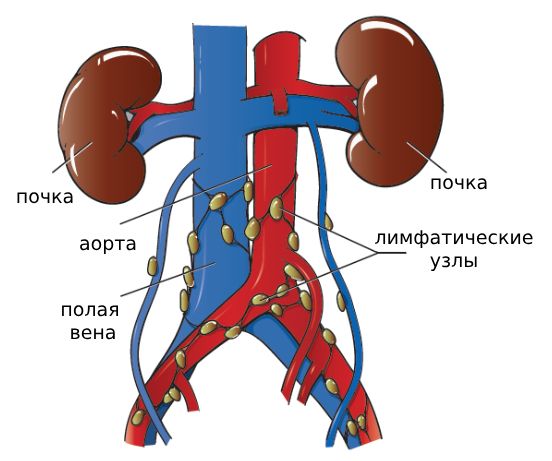
Парааортальные лимфоузлы
С током крови метастазы чаще всего распространяются в органы грудной полости (например, в лёгкие), реже — в печень. В таких случаях появляются симптомы дыхательной и печёночной недостаточности: одышка, слабость при минимальной физической активности, пожелтение кожи и слизистой, боль и дискомфорт в правом подреберье, потеря аппетита, тошнота, рвота, повышение температуры до 37–38 °C.
Иногда у пациента выявляют тромб — опухолевую массу в сосудистой системе нижней полой вены [2]. Он может перекрыть просвет сосуда, что вызывает нарушения в его работе. При прогрессировании тромбоза у пациента может появиться онемение, отёчность ног, снижение артериального давления, боль в животе, спине и области малого таза.
Диагностика нефробластомы
Первичной диагностикой опухоли Вильмса занимается педиатр. После установления диагноза пациента направляют к детскому онкологу, онкологу-радиологу, химиотерапевту и другим специалистам в зависимости от показаний.
В первую очередь врач собирает анамнез (историю заболевания). При этом он обращает внимание на наследственные болезни и врождённые аномалии, диагностированные у ближайших родственников, например уменьшение или отсутствие почки, добавочная почечная артерия, нарушение формирования половых органов и т. д.
Далее врач интересуется у родителей, что поменялось в поведении ребёнка и с чем это может быть связано. Если ребёнок старше 3 лет, врач уточняет, как у него складываются отношения в коллективе (детском саду, школе и т. д.), нет ли комплексов.
При физикальном осмотре педиатр тщательно прощупывает область живота, что позволяет ему выявить увеличенную почку, поражённые близлежащие лимфоузлы, а также помогает оценить, как органы брюшной полости и забрюшинного пространства располагаются относительно друг друга, всё ли находятся на своём месте.
Лабораторная диагностика
Для начала необходим стандартный набор клинико-лабораторных исследований: общий анализ крови и мочи, коагулограмма, биохимический анализ крови (в этом случае важное значение имеют показатели креатинина, мочевины и электролиты в сыворотке крови).
При подозрении на нефробластому врач также назначает цитогенетическое исследование, которое позволяет выявить мутации гена WT1, удвоение отцовской аллели 15-го и потерю 13-го короткого плеча в 11-й хромосоме. В ходе этого обследования изучают препараты крови, реже клетки костного мозга или культуры фибробластов (клеток, которые влияют на упругость и эластичность кожи). Такое исследование проводят, чтобы уточнить диагноз до операции.
Инструментальная диагностика
К обязательным методам обследований относятся:
- УЗИ органов брюшной полости, почек, почечных сосудов и нижней полой вены — помогает уточнить расположение и размер новообразования, определить границы поражения органов опухолью и спланировать план оперативного лечения (исследование проводят до и после операции);
- спиральная компьютерная томография (КТ) органов брюшной полости — позволяет уточнить расположение и размер опухоли, состояние близлежащих лимфоузлов, противоположной почки, печени, почечной и нижней полой вены (это необходимо, чтобы исключить или подтвердить поражение двух почек, наличие опухолевого тромбоза и метастатическое поражение печени);
- спиральная КТ органов грудной полости — помогает выявить очаговое поражение лёгких;
- рентгенография лёгких в двух проекциях — позволяет обнаружить метастазы лёгких; если поражение видно на КТ, но оно не определяется при рентгеновском обследовании, врач может назначить биопсию подозрительных образований.

УЗИ органов брюшной полости
Окончательный диагноз ставят после операции и проведения гистологического исследования тканей удалённой опухоли [2]. Объём нефробластомы часто превышает 500 мл (в 35 % от всех случаев) [15].
Дифференциальная диагностика
При подтверждении диагноза необходимо исключить другие опухоли (например, нейробластому, лимфому, тератому, кистозную нефрому, гамартому, гаматому), ксантагранулематозный пиелонефрит, а также спленомегалию, гидронефроз, поликистоз и карбункул почки [1].
Также важно дифференцировать опухоль Вильмса и светлоклеточную саркому почки. Их гистологическая картина может быть похожа, что иногда приводит к ошибочному диагнозу. При этом прогноз саркомы хуже, чем у нефробластомы. Она чаще рецидивирует и приводит к летальному исходу.
Лечение нефробластомы
Сразу назначить верное лечение часто оказывается тяжёлой задачей, так как диагностировать нефробластому на ранней стадии достаточно трудно из-за отсутствия специфических симптомов. Когда же появляются клинические признаки, их сложно правильно интерпретировать. Решение этой проблемы базируется на комплексной терапии и включает в себя разные методы лечения: хирургическое вмешательство, лучевую и химиотерапию.
Выжидательная тактика при подозрении на такую опухоль не применима, так как она быстро растёт, — нужна операция. В ходе хирургического этапа врач тщательно осматривает органы брюшной полости, после чего удаляет поражённую опухолью почку (частично или полностью). Полное удаление нефробластомы возможно, если она небольшая и ограничена капсулой почки, также необходимо наличие соответствующих инструментов [10].
Во время операции определяют стадию заболевания, а сразу после неё передают ткани новообразования на гистологическое исследование. Оно позволяет определить гистологический тип опухоли. На основании этих результатов врач принимает решение по поводу дальнейшего лечения [6].
Обычно через 2–3 недели после удаления почки начинают лучевую терапию органов брюшной полости. Суммарная очаговая доза облучения зависит от стадии и гистологического варианта опухоли. Курс лучевой терапии составляет 7–10 дней. Тем пациентам, у которых рентгенография грудной клетки выявила метастатическое поражение, также показано облучение ткани лёгких.
Химиотерапия также является обязательным компонентом лечения нефробластомы. Её могут проводить как до операции, так и после. Для этого используют различные препараты, например Винкристин, Дактиномицин, Доксорубицин, Циклофосфамид и т. д. Обычно до операции препарат принимают в течение 4 недель, т. е. пациент получает всего 4 дозы. Далее, на 5–6-й неделе, проводят хирургический этап, после чего возобновляют химиотерапию. Препарат, дозировка и кратность приёма определяют индивидуально [3][4].
Перед началом каждого курса химиотерапии пациент должен сдать клинический анализ крови и клинико-лабораторные тесты, которые помогают оценить работу печени (определяют уровень аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ) и др.).
Осложнения в послеоперационном периоде случаются в 12,7 % случаев [4]. Среди них чаще других выявляют:
- непроходимость на уровне тонкого кишечника;
- острую кровопотерю;
- воспаление раны;
- повреждения соседних органов (сердца, лёгких, печени и др.), которые были нанесены во время операции;
- развитие вторичных опухолей на фоне химио- и лучевой терапии, которые подавляют иммунитет;
- застойную сердечную недостаточность — возможна при приёме антрациклинов (например, Доксорубицина), поэтому лечение такими препаратами должно сопровождаться динамическим контролем состояния сердца с помощью УЗИ, электрокардиографии и т. д. [2];
- гепатотоксичность — повреждение печени, вызванное лучевой терапией или лечением цитостатическими антибактериальными препаратами (Дактиномицином);
- нарушение репродуктивной функции — иногда развивается в результате воздействия лучевой терапии и применения алкилирующих препаратов;
- нарушение роста костей, сколиоз — могут наблюдаться после облучения брюшной полости.
Несмотря на возможное развитие серьёзных осложнений, значимость пользы от хирургического вмешательства, лучевой и химиотерапии превышает значимость предполагаемых рисков.
Послеоперационное наблюдение
Чтобы вовремя выявить рецидив, после лечения пациенты находятся на динамическом наблюдении. Оно включает в себя:
- рентген органов грудной клетки — ежеквартально в течение 3 лет;
- УЗИ брюшной полости и забрюшинного пространства — ежеквартально в течение 7 лет, затем наблюдение проводят по показаниям;
- измерение артериального давления — проводят при каждом приёме ребёнка у терапевта;
- ЭКГ и эхокардиография — раз в год в течение 5 лет после окончания лечения или чаще, если у пациента обнаружили проблему с работой сердца после проведения лучевой терапии;
- контроль почечной функции (биохимический анализ крови, клиренс по эндогенному креатинину (определяют, какое количество крови почки могут очистить от креатинина за одну минуту), общий анализ мочи) — раз в год в течение 5 лет или чаще в зависимости от показаний.
Прогноз. Профилактика
Как правило, прогноз у детей с нефробластомой благоприятный. Трёхмодальная терапия приводит к выздоровлению 80–90 % заболевших [4][9].
Прогноз напрямую связана с гистологическим типом опухоли и стадией заболевания [10]. Признаками, свидетельствующими о неблагоприятном исходе болезни, являются: разрыв опухоли и невозможность её полностью удалить при операции, 4 стадия, которая сопровождается метастазированием (чаще всего в лёгкие) [2].
Около 15 % пациентов с опухолью Вильмса, в том числе с низкой степенью злокачественности, подвержены риску рецидива. Обычно рецидив проявляется в течение первых 2 лет после операции [13]. Также в течение ближайших 15 лет опухолевое образование может появиться в другом месте. Такое случается в 1,6 % случаев [4]. Именно поэтому необходимо регулярно наблюдаться у профильного специалиста и делать клинико-лабораторные исследования. Своевременное выявление рецидива и его лечение позволяет улучшить прогноз.
При благоприятном гистологическом варианте опухоли общая и безрецидивная четырёхлетняя выживаемость больных составляет:
При рецидивах опухоли прогноз умеренный: общая выживаемость составляет 30–40 % [4].
Профилактика нефробластомы
Специальной профилактики нефробластомы не существует, так как неизвестна точная причина её развития. Однако своевременное наблюдение ребёнка педиатром в рамках плановых осмотров уменьшает вероятность пропустить запущенный случай заболевания. Обследования ребёнка в первый год жизни проходят ежемесячно, далее педиатр осматривает малыша в год и 3 месяца, в год и 6 месяцев, в 2 года, а затем — раз в год, пока ребёнок не достигнет 17 лет [2].
Список литературы
Лопаткин Н. А. Урология: учебник. — 7-е издание, переработанное и дополненное. — М.: ГЭОТАР-Медиа, 2013. — 816 с.
Бойченко Е. И., Глеков И. В., Казанцев А. П. и др. Клинические рекомендации по диагностике и лечению детей, больных нефробластомой (опухоль Вильмса). — М., 2014.
Huszno J., Starzyczny-Słota D., Jaworska M., Nowara E. Adult Wilms' tumor — diagnosis and current therapy // Cent European J Urol. — 2013. — № 1. — Р. 39–44.ссылка
Лопаткин Н. А. Урология: национальное руководство. — М.: ГЭОТАР-Медиа, 2013. — 808 с.
Осипова В. Н. Диагностический справочник уролога. — М.: АСТ, 2009. — 257 с.
Дурнов Л. А. Руководство по детской онкологии. — М.: Миклош, 2003. — 503 с.
Лойманн Э., Цыгин А. Н., Саркисян А. А. Детская нефрология. — М.: Литтерра, 2010. — 400 с.
Романова О. Н., Зборовская А. А., Кочубинский Д. В., Станкевич З. А., Сукало А. В. Эмбриональные опухоли в детском возрасте (нефробластома и нейробластома): учебно-методическое пособие. — Минск: Белорусский государственный медицинский университет, 2011. — 36 с.
Saltzman A. F., Cost N. G., Romao R. L. P. Wilms Tumor // Urol Clin North Am. — 2023. — № 3. — Р. 455–464. ссылка
Kaste S. C., Dome J. S., Babyn P. S. et al. Wilms tumour: prognostic factors, staging, therapy and late effects // Pediatr Radiol. — 2008. — № 1. — Р. 2–17.ссылка
Рыков М. Ю. Детская онкология: клинические рекомендации по лечению пациентов с солидными опухолями. — М.: ГЭОТАР-Медиа, 2017. — 368 с.
Kim H. H. R., Hull N. C., Lee E. Y., Phillips G. S. Pediatric Abdominal Masses: Imaging Guidelines and Recommendations // Radiol Clin North Am. — 2022. — № 1. — Р. 113–129.ссылка
Leslie S. W., Sajjad H., Murphy P. B. Wilms Tumor // StatPearls. — 2023. ссылка
Caldwell B. T., Wilcox D. T., Cost N. G. Current Management for Pediatric Urologic Oncology // Adv Pediatr. — 2017. — № 1. — Р. 191–223.ссылка
Караваева Е. А. Клинические симптомокомплексы в диагностике опухолей почек у детей // РМЖ. Мать и дитя. — 2023. — Т. 6, № 3. — С. 304–309.

