Определение болезни. Причины заболевания
HpgV-инфекция (Human pegivirus-1) — это вирусная инфекция, которая не вызывает гепатита в классическом смысле. Чаще всего она протекает бессимптомно и не относится к истинным гепатотропным вирусам, вызывающим воспаление печени (гепатит).
Human pegivirus (HPgV), ранее известный как вирус гепатита G, был открыт в середине 90-х годов XX века. Учёные заметили, что по своей генетической структуре он близок к вирусу гепатита С (HCV), поэтому отнесли его к тому же семейству вирусов — Flaviviridae.
Сначала учёные считали, что именно этот вирус вызывает острый гепатит у людей, у которых не находили вирусы А, В, С, D или Е. Однако дальнейшие исследования показали, что прямой связи между HPgV-инфекцией и развитием гепатита нет [1].
В 2013 году вирус официально переименовали в Human pegivirus (HPgV). Сейчас выделяют два типа: HPgV-1 (основной и наиболее изученный) и HPgV-2 (обнаружен в 2015 году) [2]. Именно HPgV-1 способен длительно присутствовать в организме, вызывая хроническую (постоянную) инфекцию, однако для здорового человека с нормальным иммунитетом он практически безвреден: вирус не вызывает заметных симптомов и не приводит к серьёзным заболеваниям печени. Несколько иначе ситуация складывается у людей с выраженным иммунодефицитом (например, на поздних стадиях ВИЧ-инфекции): у таких пациентов HPgV может быть причиной развития лимфом.
По строению вирус похож на HCV: это сферическая частица с оболочкой, содержащая одноцепочечную РНК. Однако в отличие от вируса гепатита С, который обычно размножается в клетках печени, HPgV — лимфотропный вирус, т. е. он размножается в клетках иммунной системы (Т- и В-лимфоцитах, а также в моноцитах) [12]. Именно поэтому его чаще всего находят в крови, костном мозге и селезёнке, а не в печени [11].
У HPgV-1 выделяют семь основных генотипов с несколькими подтипами. Их распределение зависит от региона: в Африке преобладает генотип 1, во Вьетнаме — генотип 4. Однако самые распространённые — генотипы 2 и 3. В Европе, США и России доминирует генотип 2 (особенно подтип 2a) [4][5].
Распространённость HpgV-инфекции
HpgV-инфекция встречается довольно редко. По некоторым данным, его носителями являются около 750 млн человек [3]. Наибольшая заболеваемость отмечается в Новой Гвинее, Центральной и Южной Африке. Считается, что именно оттуда вирус распространился по миру.
Чаще всего вирус встречается именно у пациентов с ВИЧ-инфекцией (20–40 %) и у людей с хроническим гепатитом С (около 20 %). Это объясняется общими путями передачи. В России ВИЧ-инфекция сочетается с носительством HPgV примерно в 26 % случаев [5].
Также повышенная распространённость наблюдается у пациентов с заболеваниями крови (7–38 %) и людей на гемодиализе (более 10 %), тогда как среди здоровых доноров крови она составляет всего 1–5 % [6][8].

Гемодиализ
Причины развития гепатита G
Источник вируса в природе всё ещё неизвестен. Родственные пегивирусы обнаружены у многих животных: летучих мышей, лошадей, грызунов, свиней и приматов. У лошадей HPgV-подобный вирус вызывает инфекционный гепатит (болезнь Тейлера), но у человека и других приматов в естественных условиях похожая патология не описана [10].
Вирус передаётся несколькими путями: через кровь (парентерально), половым путём и от матери к ребёнку во время беременности или родов.
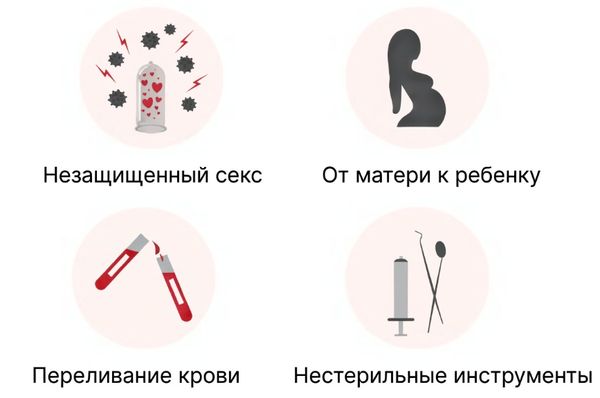
Пути передачи
Симптомы инфекции HPgV (гепатита G)
HpgV-инфекция протекает бессимптомно и не вызывает никаких заметных повреждений. Даже при скоплении большой концентрации вируса в крови он не приводит к болезни у людей с нормальным иммунитетом. Вирус может годами оставаться в организме, не вызывая воспаления печени или других проблем [6][7].
В 1996 году учёные проводили исследования, целью которых было определить, является ли HpgV причиной развития острого или хронического гепатита, как это предполагалось при открытии вируса. Однако результаты оказались отрицательными: прямой причинно-следственной связи между HPgV и развитием гепатита не нашли.
Современные данные полностью подтверждают этот вывод. Нет убедительных доказательств того, что вирус вызывает какое-либо заболевание у человека. В частности, не удалось установить надёжную связь между HPgV и раком печени (гепатоцеллюлярной карциномой), криоглобулинемией, красным плоским лишаем и гематологическими заболеваниями [8].
В 1998 году исследователи также провели эксперимент на шимпанзе — ближайших родственниках человека по иммунной системе. Животным ввели сыворотку крови пациента, содержащую вирус HPgV. Уже через 10 дней у всех шимпанзе была зафиксирована виремия: вирус распространился по организму и обнаруживался в крови. Однако ни у одного животного не возник гепатит. При этом у части обезьян временно повысился уровень печёночных ферментов (АЛТ и АСТ). Но это повышение не было связано напрямую с вирусом и, вероятно, зависело от других причин. Таким образом, даже при высокой вирусной нагрузке в крови печень оставалась неповреждённой [9].
Патогенез инфекции HPgV (гепатита G)
Патогенез инфекции HPgV изучен не полностью. Известно, что вирус проникает в клетки человека через те же рецепторы, которые использует вирус гепатита С — рецепторы липопротеидов низкой плотности (LDL-рецепторы). После присоединения к рецептору вирусная оболочка сливается с мембраной клетки, и генетический материал вируса попадает внутрь. Дальнейшее распространение HPgV по организму, по-видимому, происходит с помощью микровезикул — крошечных пузырьков, с помощью которых клетки передают друг другу белки. Эти микровезикулы способны переносить вирус в ещё не заражённые клетки [3].
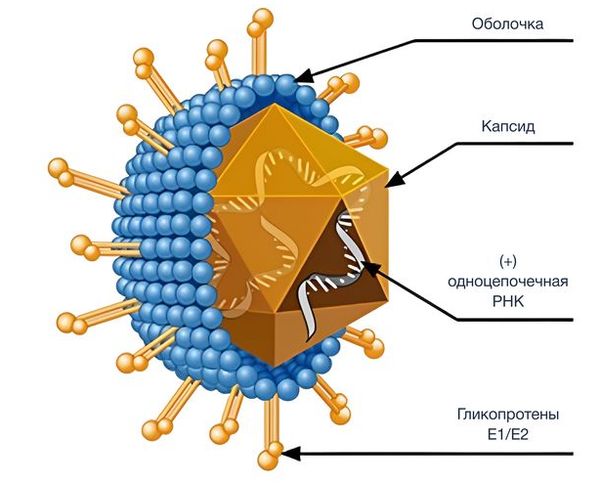
Строение вируса
После заражения острая фаза инфекции развивается не сразу, а только через 14–20 дней. Её выявляют с помощью лабораторных исследований, когда в крови обнаруживают РНК вируса. У людей с нормальным иммунитетом вирус может оставаться в крови до двух лет, после чего, как правило, полностью исчезает благодаря выработке специфических антител к оболочечному белку E2. У пациентов с ослабленным иммунитетом вирус способен сохраняться десятилетиями [1][8].
Далее наступает фаза выздоровления: РНК вируса перестаёт определяться в крови, а антитела к белку E2 становятся признаком перенесённой инфекции. Со временем эти антитела тоже исчезают из кровотока [8][22].
HpgV и ВИЧ
Одна из самых интересных особенностей HPgV — его антагонистическое взаимодействие с ВИЧ-инфекцией. При совместной инфекции HPgV способен замедлять прогрессирование ВИЧ, снижать его активность и улучшать эффективность терапии. У пациентов с ВИЧ и HPgV количество CD4+ Т-лимфоцитов (ключевых клеток иммунитета) обычно существенно выше, чем у людей с ВИЧ без HPgV [14]. Поэтому учёные считают, что совместное присутствие в организме этих двух вирусов может быть использовано для разработки новых способов лечения ВИЧ-инфекции.
Возможные механизмы защитного действия включают несколько направлений:
- HPgV уменьшает количество рецепторов CCR5 и CXCR4 на поверхности клеток, через которые ВИЧ проникает внутрь клеток иммунитета;
- HpgV повышается уровень белка RANTES, который блокирует те же рецепторы, препятствуя заражению новых клеток ВИЧ;
- HPgV стимулирует выработку интерферона, который подавляет размножение ВИЧ [5][12].
Кроме того, при передаче ВИЧ от матери к ребёнку риск заражения ребёнка ниже, если у матери есть HPgV. Вероятно, это связано с тем, что вирус помогает сохранять больше здоровых лимфоцитов [5].
Метаанализ американских учёных, опубликованный в 2006 году, показал, что на ранних стадиях ВИЧ наличие HPgV не влияет на прогноз, но на поздних стадиях смертность среди таких пациентов снижается примерно в 2,5 раза [3][6]. Однако, несмотря на обнадёживающие данные, часть исследований не подтверждает этот эффект, поэтому среди специалистов пока нет единого мнения насчёт влияния HpgV на течение ВИЧ-инфекции [5].
Главное препятствие для глубокого понимания патогенеза HPgV — невозможность надёжно культивировать вирус в лабораторных условиях. Клетки крови от инфицированных людей быстро погибают. Жизнеспособными остаётся лишь небольшая часть клеток, но их недостаточно для полноценных экспериментов [2].
Для изучения взаимодействия вирусов учёные использовали макак, заражённых SIV (ближайшим аналогом ВИЧ). Им вводили HpgV как своеобразную «биовакцину». Результаты показали, что у макак с высокой концентрацией HPgV-подобного вируса симптомы отсутствовали. Однако в острой фазе ВИЧ-подобной инфекции HpgV не оказывал защитного действия. Судя по всему, благоприятный эффект проявляется преимущественно в хронической фазе, что соответствует некоторым эпидемиологическим данным у людей [10][20].
HpgV и гепатит С
Взаимодействие HPgV с вирусом гепатита С (HCV) также благоприятное: совместная инфекция не ухудшает течение хронического гепатита С, а напротив, уменьшает фиброз печени и нормализует уровни ферментов АСТ и АЛТ. Это связано с подавлением активности генов, отвечающих за передачу сигналов внутри Т-лимфоцитов, которые находятся в ткани печени, особенно при тройной коинфекции: HpgV + ВИЧ + HCV [17].
Таким образом, несмотря на накопленные данные, патогенез HPgV и его сложные взаимодействия с другими вирусами остаются недостаточно понятными. Для надёжного подтверждения этих закономерностей нужны долгие годы исследований. На макаках такие длительные эксперименты провести невозможно из-за относительно короткой продолжительности их жизни и высокой стоимости содержания [20]. Кроме того, пока не существует надёжной лабораторной системы культивирования вируса вне организма: до сих пор не найден точный клеточный рецептор, через который вирус проникает в клетки, а без этого невозможно создать стабильные культуры для экспериментов. Пока учёные могут полагаться только на редкие животные модели и наблюдения за пациентами.
Классификация и стадии развития инфекции HPgV (гепатита G)
Несмотря на то, что HpgV является лимфотропной, а не гепатотропной инфекцией, т. е. она не вызывает прямого поражения печени, её включают в классификацию хронических гепатитов, опубликованной в 2021 году. Также в классификацию входит:
- хронический вирусный гепатит В (ХГВ);
- хронический вирусный гепатит С (ХГС);
- хронический вирусный гепатит D (дельта);
- хронический вирусный гепатит, вызванный неопределёнными вирусами (F, HPgV-1, TTV, SENV);
- аутоиммунный гепатит;
- лекарственно-индуцированный гепатит (т. е. вызванный медикаментами);
- криптогенный гепатит (т. е. причина его развития не установлена) [18].
Других классификаций HpgV-инфекции не существует.
Осложнения инфекции HPgV (гепатита G)
Воздействуя на рецепторы иммунных клеток, HPgV может снижать активность иммунодефицитных состояний, что снижает провоспалительные механизмы иммунной системы. Однако это также повышает риск возникновения лимфомы: длительное сохранение HPgV-инфекции в Т- и В-лимфоцитах сопровождается мутациями ДНК, что также может привести к злокачественной трансформации лимфоцитов [5].
Статистически значимо повышенный риск показывают диффузные крупноклеточные В- и Т-клеточные лимфомы, а также фолликулярные лимфомы маргинальной зоны (внешнего слоя фолликула лимфоузлов, селезёнки или слизистых оболочек) [19].
Диагностика инфекции HPgV (гепатита G)
При случайном обнаружении HРgV необходимо обратиться к врачу-инфекционисту. Однако в России и мире нет рекомендаций к целевому обследованию, так как вирус не вызывает болезненные состояния [5].
Обычно для выявления HРgV-вируса необходимо два лабораторных исследования:
- полимеразная цепная реакция (ПЦР) — выявляет репликацию (размножение) вируса, что может свидетельствовать об активной инфекции [5];
- иммуноферментный анализ (ИФА) — обнаруживает вирусный гликопротеин Е2-антигена, что указывает на перенесённую HpgV-инфекцию (однако со временем антитела перестают определяться в крови) [5][22].
Лечение инфекции HPgV (гепатита G)
Так как HPgV-инфекция у здоровых людей протекает бессимптомно, не вызывая патологических изменений в организме, лечение не требуется [1].
Прогноз. Профилактика
Прогноз при инфекции HPgV обычно благоприятный. Вирус редко вызывает какие-либо заметные проблемы у людей с нормальным иммунитетом и не приводит к серьёзным заболеваниям печени или другим органам.
Особый интерес к HPgV связан с его терапевтическим потенциалом. Исследования показывают, что этот вирус способен частично сдерживать размножение и патогенное действие других серьёзных вирусов, передающихся через кровь, особенно ВИЧ-инфекции и гепатита С. Механизм такого взаимодействия до конца не ясен, но если удастся его расшифровать, это может открыть новые пути контроля над этими инфекциями, например создать препараты, которые будут имитировать защитное действие HPgV без введения самого вируса.
Профилактика HpgV-инфекции
Специфической вакцины или профилактического препарата против HPgV не существует, так как в них нет необходимости из-за низкой патогенности вируса. Чтобы снизить риск заражения, следует избегать случайных связей и незащищённых половых контактов, не употреблять наркотики и исключить прямой контакт с чужой кровью или биологическими жидкостями.
Список литературы
Yu Y., Wan Z., Wang J.-H., Yang X., Zhang C. Review of human pegivirus: Prevalence, transmission, pathogenesis, and clinical implication // Virulence. — 2022. — № 1. — Р. 324–341.ссылка
Stapleton J. T. Human Pegivirus Type 1: A Common Human Virus That Is Beneficial in Immune-Mediated Disease? // Front Immunol. — 2022. — Vol. 13. ссылка
Литвинов В. В., Фрейнд Г. Г., Коробов В. П., Шестакова А. Д. HPgV-инфекция // Молекулярная медицина. — 2021. — № 6. — С. 19–26.
Bonsall D., Gregory W. F., Ip C. L. C., Donfield S., Iles J., Ansari M. A. et al. Evaluation of Viremia Frequencies of a Novel Human Pegivirus by Using Bioinformatic Screening and PCR // Emerg Infect Dis. — 2016. — № 4. — Р. 671–678.ссылка
Базыкина Е. А., Троценко О. Е., Туркутюков В. Б., Балахонцева Л. А., Котова В. О. Молекулярно-эпидемиологическая характеристика вирусных гепатитов G и TTV в Мире и на территории Российской Федерации // Дальневосточный журнал инфекционной патологии. — 2017. — № 32. — С. 80–86.
Bhattarai N., Stapleton J. T. GB virus C: the good boy virus? // Trends Microbiol. — 2012. — № 3. — Р. 124–130. ссылка
Hoffmann R., Ruegamer T., Schaubächer J., Rohrhofer A., Kirmeß P., Fiebig K. M. et al. Exploring Viral Interference Using Peptides: Molecular Determinants of HIV-1 Inhibition by a Peptide Derived from Human Pegivirus-1 Envelope Protein E2 // ChemMedChem. — 2021. — № 8. — Р. 1290–1296. ссылка
Samadi M., Salimi V., Haghshenas M. R., Miri S. M., Mohebbi S. R., Ghaemi A. Clinical and molecular aspects of human pegiviruses in the interaction host and infectious agent // Virol J. — 2022. — № 1. ссылка
Bukh J., Kim J. P., Govindarajan S., Apgar C. L., Foung S. K. H., Wages J. Jr. et al. Experimental infection of chimpanzees with hepatitis G virus and genetic analysis of the virus // J Infect Dis. — 1998. — № 4. — Р. 855–862.ссылка
Sibley S. D., Lauck M., Bailey A. L., Hyeroba D. et al. Discovery and characterization of distinct simian pegiviruses in three wild African Old World monkey species // PLoS One. — 2014. — № 2. — Р. e98569. ссылка
Mohr E. L., Stapleton J. T. GB virus type C interactions with HIV: the role of envelope glycoproteins // J Viral Hepat. — 2009. — № 11. — Р. 757–768.ссылка
Zimmerman J., Blackard J. T. Human pegivirus type 1 infection in Asia — A review of the literature // Rev Med Virol. — 2022. — № 1.ссылка
Souza I. E., Zhang W., Diaz R. S., Chaloner K., Klinzman D., Stapleton J. T. Effect of GB virus C on response to antiretroviral therapy in HIV-infected Brazilians // HIV Med. — 2006. — № 1. — Р. 25–31. ссылка
Vimali J., Yong Y. K., Murugesan A., Ashwin R., Balakrishnan P., Raju S. et al. Surrogate Biomarkers of Disease Progression in Human Pegivirus Seropositive Human Immunodeficiency Virus-Infected Individuals // Viral Immunol. — 2023. — № 1. — Р. 55–62. ссылка
Hattori J., Okumura N., Yamazaki Y., Uchiyama M. et al. Beneficial effect of GB virus C co-infection in Human Immunodeficiency Virus type 1-infected individuals // Microbiol Immunol. — 2007. — № 2. — Р. 193–200. ссылка
Zhang W., Chaloner K., Tillmann H. L., Williams C. F., Stapleton J. T. Effect of early and late GB virus C viraemia on survival of HIV-infected individuals: a meta-analysis // HIV Med. — 2006. — № 3. — Р. 173–180.ссылка
Berzsenyi M. D., Woollard D. J., McLean C. A., Preiss S., Perreau V. M., Beard M. R. et al. Down-regulation of intra-hepatic T-cell signaling associated with GB virus C in a HCV/HIV co-infected group with reduced liver disease // J Hepatol. — 2011. — № 3. — Р. 536–544. ссылка
Мехтиев С. Н., Мехтиева О. А., Елизарова Т. Е., Андреева О. С. Хронические гепатиты: учебно-методическое пособие. — СПб.: РИЦ ПСПбГМУ, 2021.
Fama A., Larson M. C., Link B. K., Habermann T. M., Feldman A. L., Call T. G. et al. Human Pegivirus Infection and Lymphoma Risk: A Systematic Review and Meta-analysis // Clin Infect Dis. — 2020. — № 5. — Р. 1221–1228.ссылка
Bailey A. L., Buechler C. R., Matson D. R., Peterson E. J., Brunner K. G., Mohns M. S. et al. Pegivirus avoids immune recognition but does not attenuate acute-phase disease in a macaque model of HIV infection // PLoS Pathog. — 2017. — № 10. — Р. e1006692.ссылка
Köksal M. O., Pirkl M., Sarsar K., Ilktaç M., Horemheb-Rubio G., Yaman M. et al. Interplay between HIV and Human Pegivirus (HPgV) Load in Co-Infected Patients: Insights from Prevalence and Genotype Analysis // Viruses. — 2023. — № 1. ссылка
Chivero E. T., Stapleton J. T. Tropism of human pegivirus (formerly known as GB virus C/hepatitis G virus) and host immunomodulation: insights into a highly successful viral infection // J Gen Virol. — 2015. — Vol. 96. — Р. 1521–1532.ссылка

