Определение болезни. Причины заболевания
Аденома надпочечника (Аdrenal adenoma) — это доброкачественное образование, которое возникает из ткани надпочечника. Большинство аденом обнаруживаются случайно во время исследования органов брюшной полости. Такие находки опухолей надпочечников называются инциденталомами [13]. Аденомы разнообразны по строению, обычно больше 1 см в диаметре и требуют дальнейшего анализа [1].
Достоверной причины образования аденом на сегодняшний день не найдено, однако к факторам риска можно отнести наследственность и травмы [1].
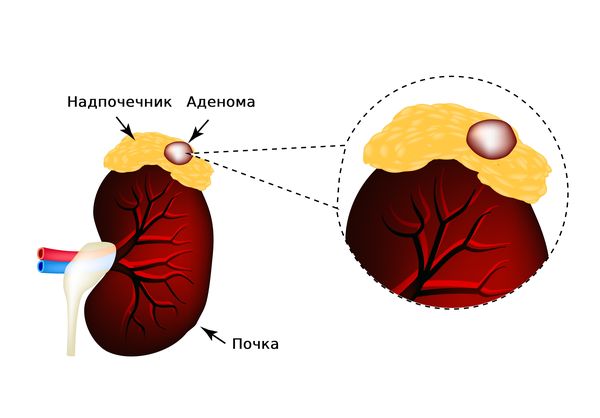
Аденома надпочечника
Распространённость
Активное использование в клинической практике аппаратов компьютерной (КТ) и магнитно-резонансной томографии (МРТ), а также их высокое качество изображения привели к тому, что инциденталомы надпочечников стали выявлять чаще [6].
В 5 % случаев при поперечном исследовании в ходе КТ или МРТ обнаруживаются образования надпочечников, 91,3 % из которых — аденомы коры надпочечников [4][5]. Частота инциденталом (в том числе аденом) надпочечников увеличивается с возрастом и составляет около 3 % у людей в возрасте до 40 лет и 10 % у людей старше 70 лет [6].
По данным патологоанатомических исследований, общая распространённость опухолей надпочечников составляет около 2 % и растёт с возрастом [16].
Типы аденом надпочечников
Аденомы надпочечников могут быть гормонально-неактивными (нефункционирующими) и гормонально-активными: с избыточным выделением кортизола (умеренная автономная секреция и явный синдром Кушинга) и альдостерона (первичный гиперальдостеронизм).
Встречаемость различного типа аденом [16]
Симптомы аденомы надпочечников
Как правило, аденома надпочечника никак себя не проявляет.
Лишь изредка, при достаточно крупных размерах гормонально-неактивного образования, пациентов могут беспокоить такие симптомы, как тяжесть или дискомфорт в спине, а именно в области надпочечников.
Область надпочечников
При гормонально-активных аденомах клиническая картина достаточно разнообразна и зависит от того, какой гормон у пациента вырабатывается в избытке:
- при аденомах с умеренной автономной секрецией кортизола (эндогенным гиперкортицизмом) пациенты испытывают проблемы с лишним весом и ожирением, повышением артериального давления и остеопорозом;
- при альдостеромах (аденомах, чрезмерно вырабатывающих альдостерон) основа клинической картины — бессимптомное повышение артериального давления, которое плохо поддаётся лечению препаратами для его снижения, а также судорожный и отёчный синдром.
При больших размерах любого образования надпочечника могут появиться признаки сдавления соседних органов: боль в поясничной области и животе, а также ощущение переполнения желудка [14].
Патогенез аденомы надпочечников
Надпочечники — это парный эндокринный орган, который производит и выделяет в кровь гормоны.
Каждый надпочечник состоит из коркового и мозгового вещества [21]. Корковое вещество подразделяется на зоны:
- Клубочковую, которая вырабатывает минералкортикоиды: альдостерон и дезоксикортикостерон. Они отвечают за поддержание внутренней среды и регуляцию артериального давления.
- Пучковую, которая вырабатывает глюкокортикоиды, главный из которых — кортизол. Они помогают организму адаптироваться к стрессовым факторам внешней среды, регулируют обмен веществ и поддерживают активность головного мозга.
- Сетчатую, где образуются половые гормоны, а именно андрогены.
Мозговое вещество отвечает за выработку катехоламинов: адреналина, норадреналина и дофамина.
Кортикостероиды (минералкортикоиды и глюкокортикоиды) жизненно необходимы в отличие от катехоламинов, тем не менее последние оказывают значительное влияние на симпатико-адреналовую систему, помогая адаптироваться организму к острым стрессам [11].
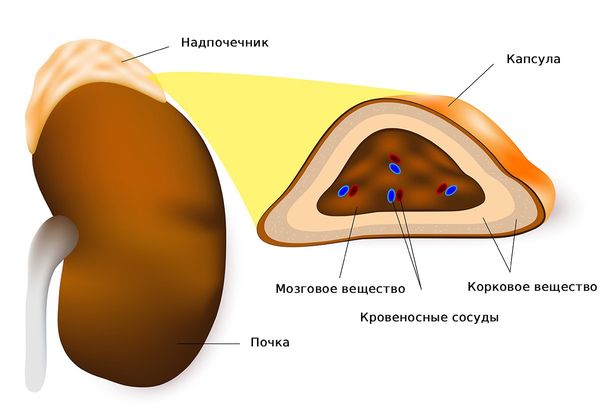
Строение надпочечника
Во время развития эмбриона надпочечники близко расположены к муллерианскому тракту, из которого формируются женские репродуктивные органы, поэтому в надпочечниках могут остаться клетки мезотелия (ткани, покрывающей внутренние органы), из которых в дальнейшем образуются аденомы [12].
Также на развитие аденом влияют генетические нарушения. Мутации в некоторых генах соматических (неполовых) клеток могут нарушить регуляцию их роста и выработки гормонов, из-за чего они начнут бесконтрольно делиться, приводя к образованию опухоли, в том числе аденомы.
Классификация и стадии развития аденомы надпочечников
По классификации Всемирной организации здравоохранения, выделяют следующие узловые образования надпочечников:
- спорадические — обнаружены случайно и не связаны с генетическими заболеваниями;
- двусторонние микронодулярные — мелкие узелки (до 4 мм) в обоих надпочечниках [22];
- двусторонние макронодулярные — крупные узлы (более 1 см) в обоих надпочечниках [9][23].
По данным компьютерной томографии, выделяют следующие типы образования надпочечников:
- доброкачественный КТ-фенотип: опухоль до 4 см, однородной структуры, низкой нативной плотности (менее 10–15 единиц Хаунсфилда (HU), которые отражают плотность образования);
- неопределённый КТ-фенотип: опухоль высокой плотности менее 4 см, низкой плотности более 4 см или мозаичной плотности (с чередованием участков разной плотности);
- злокачественный КТ-фенотип: опухоль более 4 см высокой нативной КТ-плотности (более 10 HU); любая опухоль с признаками инвазивного роста (прорастания) в соседние органы, опухолевого или сосудистого тромбоза (перекрытия сосуда частью опухоли или сгустком крови) [1][7].
Аденомы коры надпочечников — образования с доброкачественным КТ-фенотипом и могут быть гормонально-неактивными (нефункционирующими) и гормонально-активными, т. е. выделяющими избыточный кортизол или альдостерон.
Осложнения аденомы надпочечников
Существует лишь малая вероятность, что аденома переродится в адренокортикальный рак (злокачественную опухоль надпочечника). Люди с аденомами надпочечников нередко страдают от развития сердечно-сосудистых заболеваний, которые без своевременного и правильного лечения могут значительно сказаться на состоянии пациента [8].
Гормонально-активные аденомы могут вызывать следующие осложнения:
- Эндогенный гиперкортицизм приводит к таким заболеваниям, как ожирение, сахарный диабет, остеопороз, артериальная гипертензия, тромбозы, мочекаменная болезнь, депрессия, тревожные расстройства и ишемическая болезнь сердца [17].
- При такой аденоме, как ПГА (первичный гиперальдостеронизм), высока вероятность осложнений, связанных с поражением миокарда, почек и сосудов [20]. Особое значение имеет воздействие на сердечную мышцу, так как частота развития внезапной сердечной смертности возрастает в 10–12 раз [19]. Повышенные уровни артериального давления, характерные при ПГА, без лечения приводят к острому нарушению мозгового кровообращения, инфаркту миокарда, фибрилляции предсердий, развитию сердечной недостаточности, хронической болезни почек и даже к снижению когнитивных функций (умственных способностей) с последующей деменцией [18].
Любые аденомы надпочечника крупных размеров могут сдавливать соседние структуры, вызывая некроз (отмирание) тканей, нарушая функции соседних органов, например почек, что может привести к развитию острой почечной недостаточности.
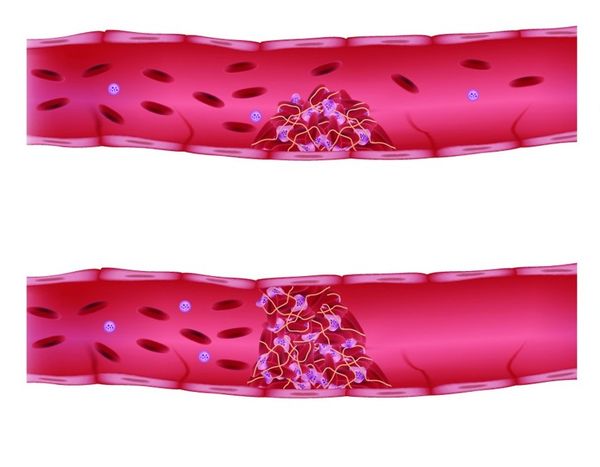
Формирование сосудистого тромба
Диагностика аденомы надпочечников
Чаще всего аденому надпочечника обнаруживают случайно: при КТ или МРТ по другому поводу. До этого момента пациента может ничего не беспокоить, поэтому к эндокринологу для дальнейшего обследования и определения тактики лечения он обычно обращается уже после находки.
Сбор анамнеза и осмотр
На приёме врач в первую очередь собирает анамнез (историю жизни и болезни) пациента, акцентируя внимание на информации о повышении артериального давления, наборе веса, судорожном и болевом синдроме.
Так как чаще всего аденомы неактивны, то при осмотре пациента врач может не увидеть никаких признаков заболевания. Если у пациента эндогенный гиперкортицизм, то доктор отметит «лунообразное лицо», центрипитальное (по типу «яблоко») перераспределение подкожно-жировой клетчатки, абдоминальное ожирение, багровые стрии на передней поверхности живота, множественные синяки, покрасневшие щёки, повышенное давление, мраморный оттенок кожи, тонкие руки и ноги, а также избыточный рост волос у женщин [21].
Далее врач может направить пациента пройти инструментальные и лабораторные исследования.

Распределение подкожно-жировой клетчатки по типу «яблоко»
Инструментальная диагностика
Чтобы отличить злокачественные опухоли надпочечников от доброкачественных, в зависимости от клинического случая применяют исследования:
- КТ;
- МРТ;
- позитронно-эмиссионную томографию с 2-[18F]фтор-2-дезокси-D-глюкозой (в основном в сочетании с КТ — FDG-ПЭТ/КТ) [16].

Позитронно-эмиссионная томография (ПЭТ)
В ходе КТ можно определить, является ли образование доброкачественным, даже без контрастного вещества (специальной жидкости для улучшения изображения). Если опухоль однородная и плотностью ≤ 10 единиц HU (что говорит о высоком содержании липидов), это указывает на её незлокачественность и детальнее рассматривать аденому нет необходимости [16].
Если КТ без контрастного усиления показывает однородное образование в надпочечниках плотностью от 11 до 20 единиц HU и размером менее 4 см, а результаты гормонального обследования отрицательные, то необходимо провести дополнительное обследование (КТ или МРТ с контрастированием или позитронно-эмиссионную томографию с 2-[18F]фтор-2-дезокси-D-глюкозой) [16].
По критериям RECIST 1.1, которые оценивают изменения размеров солидных (нежидкостных) опухолей при обследованиях, подозрительным следует считать увеличение наибольшего диаметра образования более чем на 20 % и как минимум на 5 мм. Если размер аденомы не изменился, дальнейших исследований не требуется [16].
Лабораторная диагностика
При впервые выявленном образовании надпочечников необходимо оценить его гормональную активность.
1. Исключение эндогенного гиперкортицизма
В ходе диагностики важно исключить эндогенный гиперкортицизм, так как если аденома вырабатывает кортизол, то после её удаления может развиться послеоперационная острая надпочечниковая недостаточность с высоким риском летальности.
Пациентам рекомендовано выполнить ночной подавляющий тест с 1 мг Дексаметазона:
- Накануне исследования в 23:00 выпить 2 таблетки Дексаметазона по 0,5 мг.
- На следующий день в ранние утренние часы (8:00 до 9:00) сдать кровь на уровень кортизола в крови.
Результаты теста:
- Положительный — уровень гормона ниже 50 нмоль/л. В этом случае избыточная автономная секреция кортизола корой надпочечников исключается, т. е. организм успешно снижает его уровень.
- Возможная автономная секреция кортизола — при уровне гормона от 50 до 140 нмоль/л, т. е. опухоль может оказаться гормонально-активной [15].
- Подтверждённый эндогенный гиперкортицизм — уровень кортизола более 140 нмоль/л.
При нахождении кортизола в «серой зоне» (от 50 до 140 нмоль/л) рекомендуется пройти расширенную диагностику с двухдневным тестом Лиддла. Недостаток исследования — необходимость проведения в условиях стационара. Находясь в больнице, пациент должен:
- Собрать суточную мочу для анализа.
- Принять Дексаметазон в дозе 0,5 мг 4 раза в сутки через равные промежутки времени в течение 2 дней.
- После приёма препарата снова собрать суточную мочу для анализа.
Результаты теста:
- Положительный — уровень гормона в суточной моче снижается в два или более раза по сравнению с фоновым. Это исключает избыточную выработку кортизола [15].
- Сомнительный. В этом случае проводится большой тест с 8 мг Дексаметазона.
2. Определение АКТГ
Если избыток кортизола подтверждён, следующий этап диагностики — определение адренокортикотропного гормона (АКТГ) в крови в ранние утренние часы (с 8:00 до 9:00). Тест необходим, чтобы отличить АКТГ-зависимый гиперкортицизм от АКТГ-независимого (т. е. чтобы понять, вырабатывает опухоль АКТГ или нет):
- Если подтверждён АКТГ-независимый гиперкортицизм (синдром Кушинга), проводят забор крови из надпочечниковых вен. Это помогает определить, какой из надпочечников вырабатывает больше гормонов.
- Если подтверждён АКТГ-зависимый гиперкортицизм, проводят МРТ гипофиза с контрастом, чтобы найти аденому, которая производит гормон (кортикотропиному).
Такая многоэтапная диагностика позволяет избежать ошибок в хирургической тактике лечения.
3. Исключение ПГА
Исключение ПГА рекомендовано пациентам при сочетании аденомы надпочечника и повышенного артериального давления [10].
Для этого пациент сдаёт анализ крови, перед которым следует находиться в вертикальном положении в течение 2 часов.
Диагноз ПГА подтверждается:
- при уровне альдостерона более 100 пг/мл;
- активности ренина плазмы менее < 1 нг/мл/ч;
- низком уровне калия (но у некоторых пациентов сохраняется нормокалиемия, т. е. нормальный уровень калия) [1][10].
При сомнительных результатах проводят функциональные пробы в условиях стационара:
- маршевую (определение проходимости глубоких вен);
- тест с натриевой нагрузкой;
- с физиологическим раствором;
- с Каптоприлом;
- с Флудрокортизоном.
После установки лабораторного диагноза ПГА необходимо провести забор крови из вен надпочечников, чтобы определить, какой из них вырабатывает больше альдостерона. Нередко бывает, что образование находится с одной стороны, а гормон избыточно вырабатывается с другой. Этот специфический метод исследования помогает выбрать наиболее точную хирургическую тактику.
Биопсия аденомы
Проведение биопсии аденомы, т. е. забора её ткани для анализа, может вызвать осложнения, поэтому этот метод диагностики не рекомендуется [16]. Биопсия показана, чтобы исключить метастазы, если в ходе КТ выявлены подозрительных признаки аденомы и в анамнезе пациента есть злокачественные образования за пределами надпочечника [14].
Лечение аденомы надпочечников
При нефункционирующих аденомах надпочечника рекомендована выжидательная тактика. Вопрос о необходимости хирургического вмешательства решается индивидуально на медицинских консилиумах командой врачей, в состав которой входит эндокринолог, хирург и онколог [1][16].
Операция проводится, если:
- аденома растёт или стала гормонально-активной;
- у опухоли неопределённый КТ-фенотип, т. е. выявлены рентгенологические признаки, указывающие на подозрительные характеристики опухоли;
- опухоль гормонально-активна [3].
При двусторонних образованиях вопрос об операции решается индивидуально из-за высокого риска смерти при острой надпочечниковой недостаточности, которая может развиться после удаления двух надпочечников.
Медикаментозная терапия после операции
После односторонней адреналэктомии (удаления надпочечника) при нефункционирующей аденоме заместительная терапия не требуется. В послеоперационном периоде пациентам с гормонально-активными аденомами, которым была выполнена односторонняя адреналэктомия, назначается заместительная гормональная терапия сроком до 12–24 месяцев. После удаления обоих надпочечников для коррекции надпочечниковой недостаточности гормональная терапия рекомендована пожизненно [2].
Адреноалэктомия
Прогноз. Профилактика
При нефункционирующей аденоме надпочечника прогноз чаще благоприятный — в редких случаях она может переродиться в адренокортикальный рак [9][8].
Не существует мер профилактики, чтобы полностью предотвратить появление аденомы. Если она уже возникла, очень важно диагностировать её как можно раньше и наблюдать развитие аденомы в динамике. Эти действия помогут избежать возможных осложнений.
Список литературы
Бельцевич Д. Г., Трошина Е. А., Мельниченко Г. А., Платонова Н. М. и др. Проект клинических рекомендаций «Инциденталома надпочечника» // Эндокринная хирургия. — 2020. — Т. 15, № 1. — С. 4–26.
Чаусова В. Г. Возможности выполнения органосохраняющих операций при образованиях надпочечников: дис. ... канд. мед. наук: 14.01.17. — СПб., 2017. — 136 с.
Terzolo M., Stigliano A., Chiodini I., Loli P. et al. AME position statement on adrenal incidentaloma // Eur J Endocrinol. — 2011. — Vol. 164, № 6. — P. 851–870.ссылка
Song J. H., Chaudhry F. S., Mayo-Smith W. W. The incidental adrenal mass on CT: prevalence of adrenal disease in 1,049 consecutive adrenal masses in patients with no known malignancy // AJR Am J Roentgenol. — 2008. — Vol. 190, № 5. — P. 1163–1168. ссылка
Bovio S., Cataldi A., Reimondo G., Sperone P. et al. Prevalence of adrenal incidentaloma in a contemporary computerized tomography series // J Endocrinol Invest. — 2006. — Vol. 29, № 4. — P. 298–302.ссылка
Zhao X., Zhou J., Lyu X., Li Y. et al. A novel model using leukocytes to differentiating mild autonomous cortisol secretion and non-functioning adrenal adenoma // Sci Rep. — 2024. — Vol. 14, № 1. ссылка
Terzolo M., Stigliano A., Chiodini I., Loli P. et al. AME position statement on adrenal incidentaloma // Eur J Endocrinol. — 2011. — Vol. 164, № 6. — P. 851–870.ссылка
Patrova J., Mannheimer B., Lindh J. D., Falhammar H. Mortality in Patients With Nonfunctional Adrenal Tumors // JAMA Intern Med. — 2023. — Vol. 183, № 8. — P. 832–838.ссылка
Mete O., Erickson L. А., Juhlin C. C., de Krijger R. R. et al. Overview of the 2022 WHO Classification of Adrenal Cortical Tumors // Endocrine Pathology. — 2022. — Vol. 33. — P. 155–196.
Young W. F. Jr. Diagnosis and treatment of primary aldosteronism: practical clinical perspectives // J Intern Med. — 2019. — Vol. 285, № 2. — P. 126–148.ссылка
Дедов И. И., Мельниченко Г. А., Фадеев В. В. Эндокринология. — М.: Медицина, 2000. — 632 с.
Шингареева Л. А., Байков Д. Э., Ряховский А. Е., Васкаева Г. Р. Аденоматоидная опухоль надпочечников // Инновационная наука. — 2017. — № 12. — C. 197–198.
Mahmood E., Loughner C. L., Anastasopoulou C. Adrenal Adenoma // StatPearls. — 2023. ссылка
Селиванова Л. С., Рослякова А. А., Коваленко Ю. А., Боголюбова А. В. и др. Современные критерии диагностики адренокортикального рака // Архив патологии. — 2019. — Т. 81, № 3. — С. 66–73.
Шустов С. Б. Функциональная и топическая диагностика в эндокринологии. — М.: ГЭОТАР-Медиа, 2017. — 272 с.
Fassnacht M., Tsagarakis S., Terzolo M., Tabarin A. et al. European Society of Endocrinology clinical practice guidelines on the management of adrenal incidentalomas, in collaboration with the European Network for the Study of Adrenal Tumors // European Journal of Endocrinology. — 2023. — Vol. 189, № 1. — P. 1–42.
Российская ассоциация эндокринологов. Болезнь Иценко — Кушинга: клинические рекомендации. — М., 2021. — 75 с.
Российское кардиологическое общество. Артериальная гипертензия у взрослых. — М., 2024. — 220 с.
Мельниченко Г. А., Платонова Н. М., Бельцевич Д. Г., Юкина М. Ю. и др. Первичный гиперальдостеронизм: диагностика и лечение. Новый взгляд на проблему. По материалам Проекта клинических рекомендаций Российской ассоциации эндокринологов по диагностике и лечению первичного гиперальдостеронизма // Consilium Medicum. — 2017. — Т. 19, № 4. — C. 75–85.
Milliez P., Girerd X., Plouin P. F., Blacher J. et al. Evidence for an increased rate of cardiovascular events in patients with primary aldosteronism // J Am Coll Cardiol. — 2005. — Vol. 45, № 8. — P. 1243–1248.ссылка
Баранов В. Л., Бондаренко М. В., Кадин Д. В., Логинов А. Б. Эндокринология: руководство для врачей в 2 т. / под ред. С. Б. Шустова. — СПб.: СпецЛит, 2011. — Т. 1. — C. 280–289.
Шевэ А., Бельцевич Д. Г., Абросимов А. Ю., Деркач Д. и др. Клинико-генетическая гетерогенность двусторонней микронодулярной гиперплазии надпочечников // Эндокринная хирургия. — 2020. — Т. 15, № 1. — С. 27–35.
Шевэ А., Елфимова А. Р., Бельцевич Д. Г. Клинико-лабораторные особенности макронодулярной двусторонней гиперплазии надпочечников // Проблемы эндокринологии. — 2023. — Т. 69, № 3. — С. 58–67.

