Определение болезни. Причины заболевания
Тимома (Thymoma) — это редкий вид опухоли, возникающий из эпителиальных клеток тимуса (вилочковой железы), расположенного в переднем отделе средостения. Эпителиальные клетки формируют структуру органа и образуют основную часть мозгового вещества.

Тимома
Распространённость тимомы
Среди всех первичных опухолей переднего средостения (у взрослых) тимомы и карциномы тимуса встречаются чаще всего (на их долю приходится 20 %) [15]. Несмотря на то, что большинство тимом имеют низкую степень злокачественности, в некоторых случаях они могут прорастать в окружающие ткани и давать отдалённые метастазы, т. е. распространяться на другие органы. К счастью, среди всех новообразований тимуса инвазивная тимома и карцинома встречаются только в 0,2–1,5 % случаев [18].
Заболевание может возникать у людей любого возраста, но чаще диагностируют у пациентов в возрасте 40–60 лет [2].
По одним данным, тимома встречается преимущественно у женщин, в других — у мужчин, но в большинстве исследований отмечается, что женщины и мужчины болеют одинаково часто [21]. У детей опухоль развивается крайне редко [2].
Причины и факторы риска
Точные причины развития тимомы остаются недостаточно изученными, однако выделяют ряд потенциальных факторов, связанных с генетическими, иммунными и внешними воздействиями:
- генетические:
- хромосомные отклонения (например, делеции в области хромосомы 6q и 9p) [6];
- редкие случаи семейной предрасположенности;
- синдромы, связанные с нарушением иммунного ответа (например, синдром Блума и атаксия-телангиэктазия);
- иммунные нарушения:
- аутоиммунные заболевания, т. е. когда иммунная система начинает ошибочно атаковать собственные ткани: системная красная волчанка, ревматоидный артрит, гипогаммаглобулинемия (низкий уровень иммуноглобулинов в крови, что повышает риск инфекций);
- паранеопластические синдромы (например, клеточная аплазия красного ростка крови, синдром Кушинга);
- условия окружающей среды:
- ионизирующее излучение (например, лучевая терапия головы и шеи, однако облучение с диагностической целью не влияет на развитие тимомы);
- профессиональные вредности (работа с канцерогенами, химикатами и радиационным фоном);
- другое:
- возрастные изменения в структуре тимуса (накопление мутаций и нарушения иммунного статуса);
- первичная гиперплазия тимуса, т. е. его увеличение (часто сочетается с миастенией, т. е. слабостью различных мышц).
Симптомы тимомы
Признаки тимомы зависят от того, как быстро растёт опухоль и давит ли она на окружающие структуры. Иногда болезнь протекает бессимптомно и её обнаруживают случайно во время обследования по другому поводу.
Симптомы, связанные с давлением опухоли на дыхательные пути, пищевод или крупные сосуды:
- одышка — чувство нехватки воздуха, особенно при физической нагрузке;
- кашель — постоянный или возникающий без видимой причины;
- боль в груди — давление, тяжесть или дискомфорт за грудиной;
- одностороннее расширение вен на шее или груди — может быть заметно визуально, оно связано с компрессией (сжатием) верхней полой вены;
- затруднённое дыхание в положении лёжа — человеку становится легче, если он садится или лежит с приподнятым туловищем.
В редких случаях появляется:
- повышенная температура тела и снижение веса (это возможно при более крупных или агрессивных опухолях);
- синдром верхней полой вены — отёк лица, шеи, расширение вен груди (встречается редко, но требует срочного лечения);
- гипогаммаглобулинемия [4].

Синдром верхней полой вены
20–25 % людей с тимомой болеют миастенией, а у пациентов с этим аутоиммунным заболеванием обнаруживают тимому в 10–15 % случаев [3]. При этом могут проявляться следующие симптомы:
- слабость мышц, усиливающаяся к вечеру;
- двоение в глазах и опущение век;
- слабость рук и ног;
- затруднённое глотание и даже дыхание.
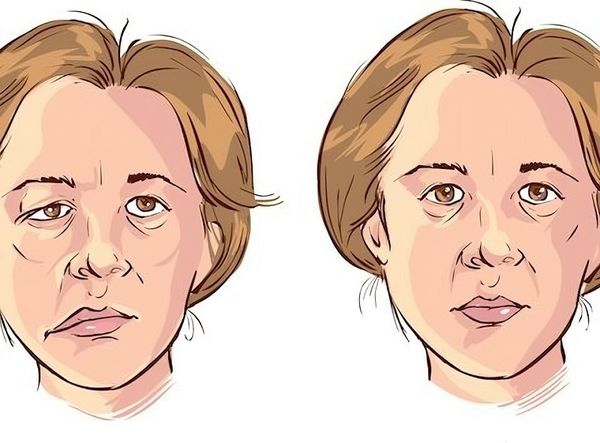
Миастения
Патогенез тимомы
Тимус играет важную роль в формировании иммунитета, особенно у детей. Его главная задача — «обучать» и доводить до зрелости Т-лимфоциты (клетки иммунной системы). Со временем вилочковая железа атрофируется, т. е. становится значительно меньше, поэтому у взрослых она уже не так активна. Однако полностью она никуда не исчезает, поэтому всё ещё может быть источником некоторых заболеваний, в том числе тимомы.
Все клетки нашего тела делятся по определённым правилам. Иногда в этом процессе возникают ошибки из-за наследственности, внешних воздействий или просто случайных сбоев. Когда такие нарушения происходят в клетках тимуса, они начинают расти хаотично и образуется опухоль [5].
Так как вилочковая железа учит нашу иммунную систему отличать свои ткани от чужеродных, то этот процесс нарушается, когда в тимусе появляется опухоль. В итоге иммунная система может ошибочно начать вырабатывать антитела, например, к мышцам. Из-за этого сигналы к ним передаются неправильно, они становятся слабыми и развивается миастения — одна из частых осложнений тимомы.
Классификация и стадии развития тимомы
По классификации ВОЗ (Всемирной организации здравоохранения), тимомы делят на типы по тому, как выглядят их клетки:
- А — самый доброкачественный. Клетки выглядят почти нормально.
- АВ — промежуточный вариант между А и В.
- В1, В2, В3 — чем выше цифра, тем больше признаков злокачественности. Особенно внимательно следят за типом В3.
Эта классификация помогает врачам понять, насколько агрессивно может вести себя опухоль [7].
Тимомы также делят по степени злокачественности:
- доброкачественная — не даёт метастазов, растёт медленно;
- атипичная — есть признаки быстрого роста, но опухоль не вышла за пределы тимуса;
- злокачественная — может прорастать в соседние органы или давать отдалённые метастазы.
Чтобы понять, насколько далеко зашла болезнь, врачи используют систему стадирования, которая помогает выбрать правильное лечение:
- I стадия — опухоль находится полностью внутри тимуса и не прорастает дальше;
- II стадия — опухоль начинает прорастать в окружающие ткани;
- III стадия — опухоль проросла в соседние органы: плевру (оболочку лёгкого), перикард (оболочку сердца) или лёгкое;
- IV стадия — опухоль с метастазами.
Осложнения тимомы
К возможным осложнениям тимомы относятся:
- Давление на соседние органы. Это самое частое осложнение. Опухоль давит на следующие структуры:
- дыхательные пути (трахею) — появляется одышка и лающий кашель;
- пищевод — могут возникнуть трудности с глотанием;
- верхняя полая вена — возможны отёки лица, шеи и увеличение вен на груди.
- Миастения. Основные симптомы: слабость при поднятии век, расплывчатость речи, вялость в руках и ногах после нагрузки [8]. У пациентов с миастенией и тимомой одновременно повышен риск развития аутоиммунного энцефалита (воспаления головного мозга). При его развитии ухудшается мышление и могут возникнуть судороги с потерей сознания. Чтобы этого избежать, важно удалить опухоль [8].
- Рост опухоли в соседние ткани. Если тимому не удалили вовремя, она может начать прорастать в близлежащие ткани, например:
- плевру;
- перикард;
- сосуды и нервы.
- Метастазирование. Хотя тимома обычно доброкачественная, в редких случаях она может распространяться на другие органы. Чаще всего это внутригрудные лимфоузлы, лёгкие и органы брюшной полости [9].
Диагностика тимомы
При симптомах тимомы необходимо обратиться к терапевту, который проведёт первичный приём, направит на дополнительное обследование и консультацию к профильному специалисту, например онкологу, торакальному хирургу, эндокринологу или неврологу.
Лабораторная диагностика
Врач может назначить общий и биохимический анализ крови. Их результаты помогают определить общее состояние организма и выявить возможные сопутствующие проблемы. При признаках миастении (например, слабости мышц или двоении в глазах) врач может проверить кровь на наличие специфических антител [10].
При подозрении на гипогаммаглобулинемию, особенно связанную с тимомой (синдром Гудпасчера), назначают специфические анализы, чтобы исключить или подтвердить диагноз, а также оценить тяжесть состояния.
Иногда для подтверждения предварительного диагноза врачи проводят биопсию — берут небольшой кусочек ткани опухоли и отправляют его на анализ. Это позволяет точно определить тип тимомы и выбрать правильное лечение [11]. Забор делается с помощью иглы под контролем компьютерной томографии (КТ) или во время диагностической операции [15]. Метод применяют в двух случаях:
- до химио- и/или лучевой терапии, если опухоль слишком большая и сразу удалить её невозможно;
- когда хирургическое лечение противопоказано из-за состояния здоровья и сопутствующих заболеваний [15].
Основные осложнения биопсии, как любой инвазивной процедуры, — травма сосудов и внутренних органов. Противопоказания — терминальное состояние пациента, т. е. наличие метастазов.
Инструментальная диагностика
Врач может назначить пациенту инструментальные обследования грудной клетки:
- Рентген. Это самый первый и простой способ определить, есть ли в груди какое-то образование. Однако из-за анатомического расположения тимомы исследование часто не позволяет её увидеть.
- Компьютерную томографию. Это наиболее точное и обязательное исследование, которое даёт объёмное изображение грудной полости. Оно помогает определить размер опухоли, её форму, расположение и давление на соседние органы.
- Магнитно-резонансную томографию (МРТ). Этот метод используется реже. Он может помочь в сложных случаях, особенно если нужно лучше рассмотреть связь опухоли с сосудами или нервами.
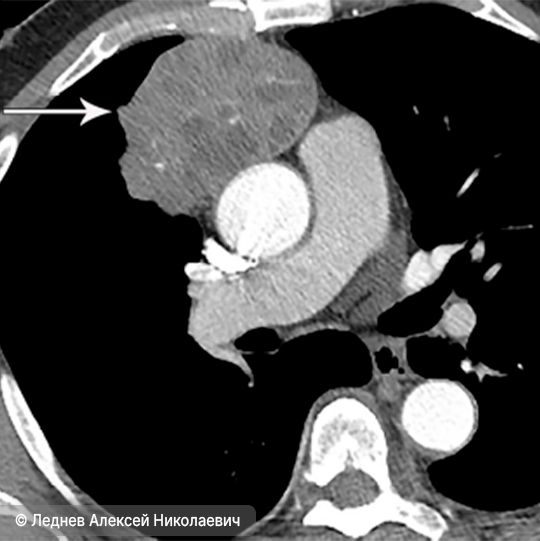
Тимома на снимке магнитно-резонансной томографии (показана стрелкой)
Дифференциальная диагностика
Тимому необходимо отличать от следующих заболевания:
- лимфомы;
- опухолей, которые лечатся терапевтически (например, лимфопролиферативных заболеваний, в частности лимфомы Ходжкина);
- кисты тимуса;
- эктопии паращитовидных желёз;
- зоба щитовидной железы;
- параганглиомы.
Лечение тимомы
Существуют разные методы лечения тимомы, в частности операция, химио- и лучевая терапия.
Хирургическое лечение
Это самый распространённый способ. Во время операции хирург удаляет всю опухоль или часть тимуса, где она находится. На этом лечение неосложнённых форм тимомы может быть закончено, особенно если опухоль доброкачественная. При связи тимомы с миастенией после удаления опухоли назначают антихолинэстеразные препараты, влияющие на мышечную проводимость [20].
Операция может проводиться различными доступами: его выбор зависит от размеров и расположения опухоли, а также навыков хирурга и оснащения клиники.
Виды доступов:
1. Через разрез по центру груди (стернотомия).
Хирург выполняет разрез по центру грудины: от верхней части до нижней. Зачастую используют более щадящую продольно-поперечную стернотомию с сохранением нижней трети тела грудины. Кость аккуратно распиливают пополам специальным инструментом, чтобы получить доступ к внутренним органам. Далее хирург находит опухоль и осторожно удаляет её вместе с тимусом. При этом он старается не повредить соседние структуры: сердце, крупные сосуды и нервы. Затем грудину фиксируют с помощью стальных металлических проволок. Кожа зашивается, и накладывается повязка.
Операция занимает от 1 до 3 часов, в зависимости от размера и сложности опухоли. Лечение проводят под общим наркозом, поэтому пациент ничего не чувствует. Если по его окончании возникает чувство давления или боли в области груди, врач назначает обезболивающие средства. Госпитализация занимает в среднем 7–10 дней.
Восстановительный период обычно проходит за 2–3 месяца. В последующем движения в верхнем плечевом поясе следует ограничивать, чтобы создать оптимальные условий для срастания грудной кости.
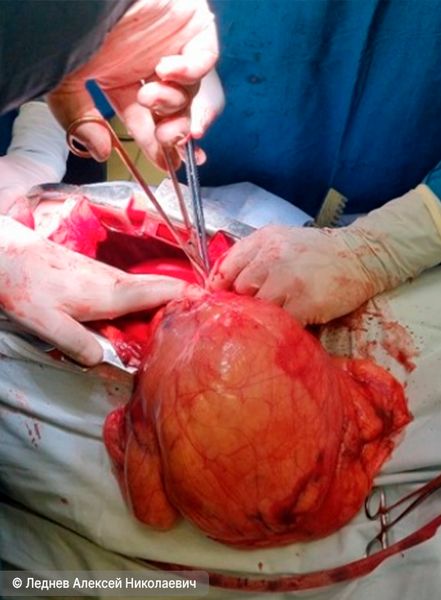
Удаление гигантской тимолипомы у пациента 27 лет (нажмите на изображение, чтобы оно появилось)
2. Через небольшие проколы в межреберьях.
Если тимома небольшая и не слишком близко расположена к важным структурам, врачи могут предложить малоинвазивные операции:
- Торакоскопию. Хирург делает 2–4 небольших разреза на груди (по 1–2 см), вводит через них специальную камеру (торакоскоп) и инструменты, чтобы увидеть опухоль и аккуратно удалить её. После этого швы закрывают и накладывают повязку. Преимущества торакоскопии:
- короткая госпитализация (3–4 дня);
- быстрое восстановление (2–3 недели): пациент ощущает меньше боли, ограничения движений минимальны и необходимы только из-за возможных неприятных ощущений;
- незаметные шрамы.
- Робот-ассистированную операцию. Этот метод похож на торакоскопию, но вместо обычных инструментов врач управляет роботом, который помогает работать более точно и целенаправленно. Сначала хирург делает несколько небольших проколов на груди. Затем он управляет роботом с помощью пульта, видя всё в трёхмерном увеличении. Руки робота двигаются под его контролем. Преимущества операции:
- более точное удаление опухоли;
- меньшая травма окружающих тканей;
- удобство для работы в труднодоступных местах;
- быстрое восстановление (2–4 недели): боль минимальна и хорошо контролируется обезболивающими, вставать можно уже на следующий день.
Если в государственной клинике есть роботический комплекс, то операции с помощью таких систем доступны при оформлении квоты на оказание высокотехнологической медицинской помощи.
При робот-ассистированной или торакоскопической операции может быть полезно специальное окрашивание: внутривенно вводят специальное вещество, чтобы определить границы тимомы, не пропустить оставшиеся очаги и не повредить нервы при прорастании в них опухоли [19]. Но эта методика новая, которая требует дальнейшего исследования.
Оба вида малоинвазивных вмешательств занимают от 1 до 2,5 часов, в зависимости от сложности. После них следует избегать тяжёлых нагрузок первые 3–4 недели.
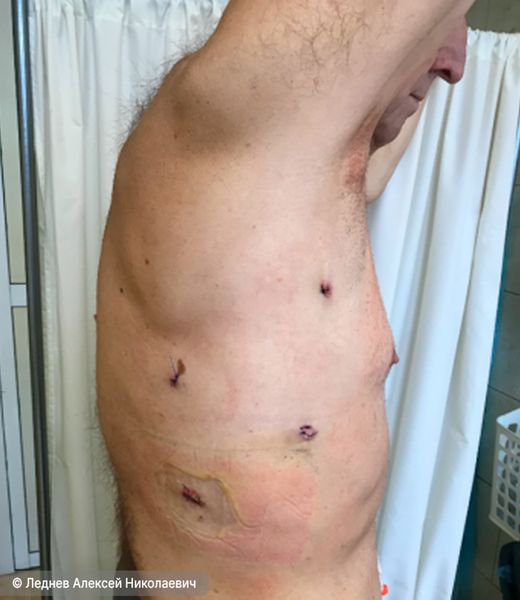
Пациент через 5 дней после малоинвазивной операции
3. Через небольшой разрез под мечевидным отростком с применением торакоскопа (субксифоидальный доступ).
Это малоинвазивная операция, при которой хирург делает один небольшой разрез под нижним краем грудины (около 3–5 см), чуть выше живота. Такой подход позволяет добраться до тимуса и тимомы без рассечения грудной кости. Через этот разрез вводится камера (эндоскоп) и специальные инструменты. Хирург аккуратно удаляет опухоль вместе с тимусом, не повреждая соседние структуры: сердце, сосуды и диафрагму. Затем он зашивает разрез внутри и снаружи, после чего накладывает повязку. Преимущества операции:
- малозаметный шрам;
- быстрое восстановление (2–4 недели): боль минимальна и хорошо контролируется обезболивающими, вставать можно уже на следующий день.
Возможные осложнения любого хирургического метода: риски кровотечения, инфекции и повреждения соседних органов [12]. Их можно устранить либо сразу во время операции, либо при необходимости проводят повторное вмешательство.
Противопоказания к хирургическому лечению:
- тяжёлое соматическое (общее физическое) состояние пациента;
- наличие декомпенсированных сопутствующих заболеваний, т. е. таких, с которыми организм пока не справляется.
Если пациент не может перенести операцию, возможно назначение альтернативных схем лечения, включая лучевую и химиотерапию.
Лучевая терапия
Это лечение с помощью специальных направленных лучей, которые убивают оставшиеся раковые клетки после операции или замедляют рост опухоли, в случае если её нельзя удалить (например, если опухоль проросла в жизненно важные органы — сердце или аорту).
Обычно терапия состоит из коротких сеансов в течение нескольких недель. Возможные побочные эффекты включают покраснение кожи (как солнечный ожог), усталость, кашель или дискомфорт в груди, а также временное снижение иммунитета.
Химиотерапия
Это лечение препаратами, которые попадают во все органы и убивают раковые клетки. Они вводятся внутривенно или принимаются в виде таблеток. Курсы повторяются с перерывами.
Врач назначает химиотерапию при агрессивных злокачественных формах тимомы или в случаях, если опухоль распространилась на другие органы.
Возможные побочные эффекты включают выпадение волос, тошноту и рвоту, усталость, восприимчивость к инфекциям, а также нарушение кроветворения (анемию, т. е. снижение уровня эритроцитов и гемоглобина в крови, и малокровие) [13].
Прогноз. Профилактика
У большинства пациентов прогноз благоприятный, особенно если тимома доброкачественная и её вовремя удалили [14].
Полное удаление опухоли во время операции обеспечивает малый риск рецидива, но полностью исключить его нельзя [17]. При злокачественном процессе прогноз определяется типом тимомы, степенью инвазии (распространения), радикальностью удаления и возрастом пациента.
Некоторых виды опухолей имеют риск рецидива спустя годы, поэтому после лечения нужен длительный контроль у врача. Программа наблюдения строится индивидуально: например, при злокачественном процессе КТ проводят раз в 3 месяца первые 2 года, затем — раз в год.
Если опухоль связана с миастенией, после операции состояние мышц зачастую улучшается. Продолжать лечение этого заболевания не нужно, если клинических и лабораторных признаков опухоли больше нет.
Профилактика тимомы
К сожалению, предотвратить появление тимомы невозможно, так как точная причина её развития неизвестна [15].
Теоретически снизить риск её появления можно, если избегать ионизирующего излучения и канцерогенов.
Профилактических обследований для групп риска (например, при системной красной волчанке или гипогаммаглобулинемии) нет.
Однако при выявлении миастении важно пройти назначенные врачом исследования, чтобы исключить тимому, которая может протекать бессимптомно.
Список литературы
Marx A., Chan J. K., Coindre J. M., Detterbeck F. et al. The 2015 World Health Organization Classification of Tumors of the Thymus: Continuity and Changes // J Thorac Oncol. — 2015. — Vol. 10, № 10. — P. 1383–1395.ссылка
Liu M., Wang C., Gao L., Lv C. et al. Clinical significance of age at diagnosis among patients with thymic epithelial tumors: a population-based study // Aging (Albany NY). — 2020. — Vol. 12, № 6. — P. 4815–4821.ссылка
Beydoun S. R., Gong H., Ashikian N. et al. Myasthenia gravis associated with invasive malignant thymoma: two case reports and a review of the literature // J Med Case Rep. — 2014. — Vol. 8. ссылка
Detterbeck F. C., Parsons A. M. Thymic tumors // Ann Thorac Surg. — 2004. — Vol. 77, № 5. — P. 1860–1869.ссылка
Барболина Т. Д., Аллахвердиев А. К., Владимирова Л. Ю., Деньгина Н. В. и др. Опухоли вилочковой железы (тимомы и рака тимуса) // Злокачественные опухоли. — 2023. — Т. 13, № 3S2–1. — С. 695–708.
Lee G. Y., Yang W. I., Jeung H. C., Kim S. C. et al. Genome-wide genetic aberrations of thymoma using cDNA microarray based comparative genomic hybridization // BMC Genomics. — 2007. — Vol. 8. ссылка
Gao C., Yang L., Xu Y., Wang T. et al. Differentiating low-risk thymomas from high-risk thymomas: preoperative radiomics nomogram based on contrast enhanced CT to minimize unnecessary invasive thoracotomy // BMC Med. Imaging. — 2024. — Vol. 24, № 1. ссылка
Zhu Y., Wang B., Hao Y., Zhu R. Clinical features of myasthenia gravis with neurological and systemic autoimmune diseases // Front Immunol. — 2023. — Vol. 14.ссылка
Di Mango A. L., Zanetti G., Marchiori E. Thymoma metastasis: Differential diagnosis of pleural nodules and masses // Lung India. — 2018. — Vol. 35, № 4. — P. 369–370.ссылка
Song Z., Zhang J., Meng J., Jiang G. et al. Different monoclonal antibodies in myasthenia gravis: A Bayesian network meta-analysis // Front Pharmacol. — 2022. — Vol. 12. ссылка
Александров О. А., Рябов А. Б., Пикин О. В. Тимома (обзор литературы) // Сибирский онкологический журнал. — 2017. — Т. 16, № 4. — С. 76–83.
Abdel Jail R., Abou Chaar M. K., Al-Qudah O., Abu Zahra K. et al. Heart rupture repair during huge mediastinal mass resection — case report // J Cardiothorac Surg. — 2020. — Vol. 15, № 1. ссылка
Riely G. J., Wood D. E., Loo B. W., Aisner D. L. et al. Thymomas and Thymic Carcinomas, Version 2.2025. NCCN Clinical Practice Guidelines in Oncology // J Natl Compr Canc Netw. — 2025. — Vol. 23, № 6. — P. 255–269.ссылка
Xu C., Zhang Q., Li J., Qiu H. et al. Prognosis and surgical outcomes of the total thymectomy versus thymomectomy in non-myasthenic patients with early-stage thymoma: a systematic review and meta-analysis // Asian J Surg. — 2023. — Vol. 46, № 9. — P. 3455–3463.ссылка
Robinson S. P., Akhondi H. Thymoma // StatPearls. — 2023.ссылка
Чевжик В. П., Бродер И. А., Аксельров М. А., Арабская Е. А. Тимома средостения у ребёнка 9 лет: клиническое наблюдение // Вятский медицинский вестник. — 2024. — Т. 84, № 4. — С. 98–100.
Ветшев П. С., Аблицов Ю. А., Аблицов А. Ю., Крячко В. С. Современный взгляд на хирургическое лечение тимомы // Вестник Национального медико-хирургического Центра им. Н. И. Пирогова. — 2017. — Т. 12, № 2. — С. 89–94.
Rajan A., Giaccone G. Treatment of advanced thymoma and thymic carcinoma // Curr Treat Options Oncol. — 2008. — Vol. 9, № 4–6. — P. 277–287.ссылка
Cao Y., Zhao X., Zhou J. Application of near-infrared fluorescence imaging with indocyanine green in mediastinal surgery // JTCVS Tech. — 2023. — Vol. 22. — P. 343–349.ссылка
Ассоциация онкологов России. Российское общество клинической онкологии. Опухоли средостения: клинические рекомендации. — М., 2020. — 92 с.
Rich A. L. Epidemiology of thymoma // J Thorac Dis. — 2020. — Vol. 12, № 12. — P. 7531–7535.ссылка

