Определение болезни. Причины заболевания
Спинальная амиотрофия Верднига — Гоффмана (Werdnig — Hoffmann disease) — это генетически обусловленное заболевание нервно-мышечной системы, при котором поражаются двигательные нейроны в сером веществе спинного мозга, а именно в передних рогах. Это приводит к уменьшению мышечной массы (атрофии), снижению тонуса и параличу мышц у детей младше 6 месяцев. Такую амиотрофию также называют спинальной мышечной атрофией (СМА) 1-го типа.
![Спинальная амиотрофия Верднига — Гоффмана [19] Спинальная амиотрофия Верднига — Гоффмана [19]](/media/bolezny/spinalnaya-amiotrofiya-verdniga-goffmanna/spinalnaya-amiotrofiya-verdniga-_-goffmana-19_s.jpeg?dummy=1764742349937)
Спинальная амиотрофия Верднига — Гоффмана [19]
Впервые спинальную мышечную атрофию описали австрийский невролог Гвидо Вердниг в 1891 году и немецкий невропатолог Иоганн Гоффман в 1893 году. Они исследовали случаи прогрессирующей мышечной слабости и атрофии у детей в возрасте от 6 до 18 месяцев, а при патологоанатомическом вскрытии обнаружили у пациентов выраженное повреждение клеток передних рогов [4].
Спинальная амиотрофия Верднига — Гоффмана — это одна из четырёх подвидов спинальных мышечных атрофий. Основные их различия заключаются в возрасте дебюта и выраженности проявлений:
- СМА 1-го типа — проявляется до полугода, малыш не способен держать голову, переворачиваться и сидеть без опоры, ко всему этому в скором времени присоединяются дыхательные нарушения;
- СМА 2-го типа (болезнь Дубовица) — развивается с 6 до 18 месяцев, ребёнок способен сидеть, но не стоит и не ходит;
- СМА 3-го типа (болезнь Кугельберга — Веландера) — появляется после 18 месяцев, ребёнок может стоять и ходить, но это вызывает у него определённые трудности;
- СМА 4-го типа — дебютирует во взрослом возрасте, у пациента сохраняется способность к передвижению, однако наблюдается постепенно прогрессирующая мышечная слабость.
Отдельно выделяют СМА 0-го типа — редчайшую разновидность СМА, при которой нарушение подвижности и мышечная слабость наблюдаются уже во внутриутробном периоде [18].
СМА — редкое заболевание: на 11 тыс. новорождённых приходится один больной ребёнок, при этом общая распространённость всех форм спинальных мышечных атрофий составляет 1–2 случая на 100 тыс. человек (такая разница в численности связана с тем, что до недавнего времени многие пациенты не доживали до взрослого возраста). Непосредственно спинальная амиотрофия Верднига — Гоффмана составляет примерно 60 % от всех СМА. Однако статистика остаётся неточной [1][2].
Причины спинальной амиотрофии Верднига — Гоффмана
Причиной заболевания является генетическая мутация в гене SMN1. Этот ген находится в локусе 5q12.2–q13.3 пятой хромосомы. Такая мутация приводит к гибели мотонейронов, из-за чего мышцы перестают работать [2].
Спинальная мышечная атрофия — это аутосомно-рецессивное заболевание, т. е. риск заболеть появляется только в том случае, когда ребёнок наследует оба дефектных гена (по одному от каждого родителя). Если у человека есть только один мутировавший ген, он становится носителем, но сама болезнь у него не развивается [2].

Аутосомно-рецессивный тип наследования
Симптомы спинальной амиотрофии Верднига — Гоффмана
Основное проявление болезни — тяжёлая мышечная слабость, которая захватывает все группы мышц, прежде всего проксимальные мышцы (те, которые расположены ближе к туловищу), поэтому другое название болезни — проксимальная спинальная мышечная атрофия 5q. Ребёнок с таким диагнозом не может держать голову, переворачиваться или сидеть. У него отсутствует двигательное развитие.
Симптомы нарастают поэтапно. Раньше других вовлекается мускулатура ног: тонус снижен, опоры на ноги нет, ребёнок может удерживать предметы в обеих руках и сидеть, но только опираясь на спину. Затем слабость нарастает в руках и шее, малыш перестаёт держать голову, даже если делал это раньше.
С течением заболевания вовлекаются и межрёберные мышцы: у пациента формируется воронкообразная грудная клетка и парадоксальное дыхание, в котором также участвуют живот и диафрагма.
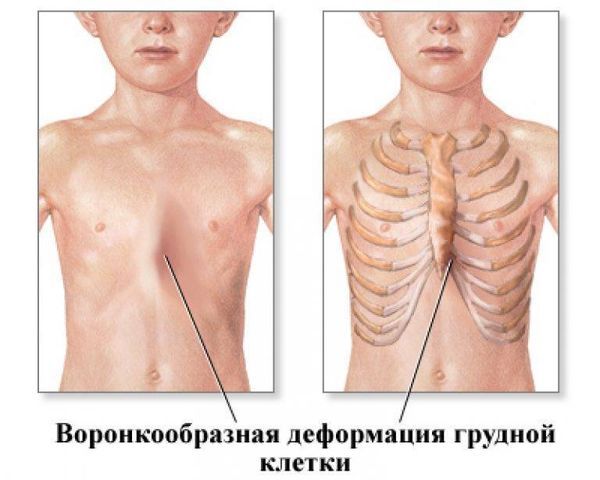
Воронкообразная грудная клетка
По мере прогрессирования мышечной атрофии появляются мелкие подёргивания мышечных пучков, которые видны невооружённым глазом. Они возникают как в крупных мышцах (например, в бедренных), так и в мелких, в том числе в тех, которые участвуют в глотании и сосании [8].
В связи со слабостью дыхательной мускулатуры у ребёнка часто развиваются респираторные инфекции и пневмония, которые нередко приводят к гибели пациента. Слабость скелетных мышц и осевой мускулатуры также сопровождается деформацией суставов и позвоночника.
На выраженность симптомов влияет количество копий гена SMN2, который, как и ген SMN1, производит белок выживаемости мотонейронов (хоть и в меньшем количестве). Таким образом, чем больше копий этого гена, тем мягче протекает СМА [3][4].
Патогенез спинальной амиотрофии Верднига — Гоффмана
Если рассмотреть спинной мозг на поперечном сечении, можно заметить серое вещество, в котором определяются передние рога. Они содержат специальные клетки — мотонейроны, которые передают импульс по нервному волокну к мышцам. Благодаря этому мышцы находятся в нормальном тонусе и могут сокращаться, т. е. руки и ноги двигаются, ребёнок способен нормально глотать, дышать и т. д.
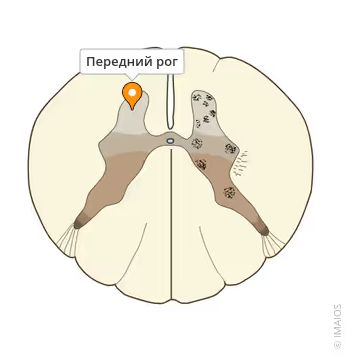
Передние рога
Работу и жизнедеятельность мотонейронов поддерживает белок SMN — белок выживаемости мотонейронов. Его кодируют гены SMN1 и SMN2 [3]. В случае мутации в гене SMN1 развивается следующая цепочка событий:
- Дефицит белка SMN.
- Мотонейроны в передних рогах погибают.
- Передача нервного импульса от передних рогов по нервам к мышцам становится невозможной.
- Мышца, не получающая нервный импульс, атрофируется и не работает.
- Пациент не может нормально двигаться.
Благодаря гену SMN2 атрофия развивается не сразу, однако он не может вырабатывать столько белка, сколько необходимо для нормальной работы мотонейронов, т. е. ген SMN2 влияет лишь на выраженность симптомов, но не может избавить от болезни полностью [3][16].
Классификация и стадии развития спинальной амиотрофии Верднига — Гоффмана
Как уже упоминалось выше, СМА 1-го типа является одной из разновидностей СМА [18].
Спинальная амиотрофия Верднига — Гоффмана включает в себя подклассы:
- Ia — наиболее тяжёлая неонатальная (младенческая) форма, при которой уже при рождении отмечается ограничение работы суставов и снижение всех рефлекторных (автоматических) движений, Ia — крайне редкий вариант, частота которого не установлена [18];
- Ib — самая частая форма, основное проявление которой — слабое или полное неудерживание головы;
- Iс — лёгкая форма, при которой ребёнок может удерживать голову и сидеть с опорой на спину [4].
Чтобы оценить объём двигательного дефицита у пациентов с СМА 1-го типа, используют шкалу CHOP INTEND (The Children’s Hospital of Philadelphia Infant Test of Neuromuscular Development), которая также подходит для диагностики других нервно-мышечных заболеваний у младенцев (например, врождённой мышечной дистрофии с миастеническим синдромом). По этой шкале отдельно оценивают разные группы мышц на обеих сторонах тела: если объём движений максимальный, эта группа мышц получает 4 балла, в обратном случае — 0. Максимально возможный балл, который может получить здоровый ребёнок, составляет 64 балла, в то время как дети с тяжёлым СМА 1-го типа могут набрать менее 20. Эту шкалу также используют, чтобы оценить эффективность лечения [5].
Осложнения спинальной амиотрофии Верднига — Гоффмана
Основные группы осложнений:
- Скелетно-мышечные — из-за низкого мышечного тонуса позвоночник, суставы рук и ног не могут оставаться в физиологичном положении, что приводит к сколиозу, контрактурам (ограничению подвижности) и вывихам суставов, а также к патологическим переломам рук и ног.
- Осложнения, связанные с нарушением глотания, — в результате недостатка воды и пищи у пациента развивается дегидратация и мальнутриция, а из-за слабости мышц брюшного пресса и тазового дна появляется склонность к запорам. Также содержимое желудка может забрасываться в пищевод (рефлюкс). Ещё более грозным осложнением при нарушенном глотании является аспирационная пневмония, когда пища и слюна попадают в дыхательные пути [12].
- Респираторные и лёгочные — из-за малой подвижности пациента у него развиваются застойные явления в лёгких, что осложняет течение вирусных и бактериальных инфекций дыхательной системы. При прогрессировании СМА дыхательная мускулатура ослабевает, что приводит к гиповентиляции — снижению газообмена между окружающей средой и лёгкими, из-за чего в крови снижается уровень кислорода, усугубляя все патологические процессы в организме [13].
- Кардиологические — ген SMN1 оказывает влияние не только на мотонейроны передних рогов, но и на другие органы и системы, поэтому кардиологические состояния могут быть как врождёнными, так и приобретёнными. К ним относятся нарушения сердечного ритма, дефекты перегородок и выносящих трактов сердца (аорты и лёгочной артерии) [14].
Именно осложнения определяют риск летального исхода, который при СМА 1-го типа прежде всего связан с респираторными и инфекционными последствиями.
Диагностика спинальной амиотрофии Верднига — Гоффмана
Основным методом диагностики является молекулярно-генетическое тестирование, которое позволяет выявить мутацию в гене SMN1 и его копии.
При первичной диагностике обычно ищут конкретный дефект — делецию (потерю) участка ДНК в обеих копиях гена [7]. Такое обследование может иметь разные названия, например «Mолекулярно-генетическое исследование мутаций в гене SMN1», «Определение хромосомных мутаций в гене SMN1» и т. д. Если мутации нет, у ребёнка находят 2 копии гена SMN1. Для правильной интерпретации результата необходимо обратиться к врачу.
Чтобы выявить количество копий SMN2, проводят отдельное исследование, которое может назначить невролог или генетик. Результаты такого тестирования позволяют предположить скорость прогрессирования заболевания. Кроме того, количество копий этого гена учитывают при назначении генной терапии.
К сожалению, если оба родителя здоровы, заподозрить болезнь у плода практически невозможно. Зачастую диагноз ставят после рождения по результатам скрининга новорождённых: кровь для исследования на СМА берут ещё в роддоме, что позволяет начать лечение как можно раньше.

Неонатальный скрининг
Известны случаи, когда скрининг не выявляет мутации, однако педиатр или невролог замечает подозрительные симптомы и назначает более развёрнутое генетическое исследование — прямое автоматическое секвенирование по Сэнгеру, которое находит другие мутации в гене SMN1, не связанные с делецией. Если генетические анализы не подтвердили СМА, проводят дополнительные лабораторные и генетические тесты для поиска наследственных болезней обмена веществ.
Вспомогательными методами диагностики СМА являются стимуляционная и игольчатая электронейромиография (ЭНМГ). Например, игольчатая ЭНМГ позволяет установить факт текущей денервации через спонтанную активность мышц: внезапные нейрофизиологические феномены в виде графиков и звуков указывают на то, что у пациента протекает процесс гибели или повреждения двигательных нервов. ЭНМГ также помогает определить, какие группы мышц не получают импульс от мотонейронов [8].
Стимуляционную и игольчатую ЭНМГ также используют для дифференциальной диагностики: они помогают отличить СМА от других заболеваний нервно-мышечной системы, например от полинейропатии, миопатии и конгенитального миастенического синдрома.
Лечение спинальной амиотрофии Верднига — Гоффмана
До недавнего времени СМА была полностью неизлечима, пока учёные из области молекулярной генетики не разработали специальные препараты, которые повышают выживаемость пациентов и значительно улучшают их двигательную активность. Сейчас в мире официально зарегистрированы 3 препарата:
- Золгенсма (Онасемноген абепарвовек) — гензаместительный препарат, благодаря которому в организм вводится копия гена SMN1 и начинается выработка белка выживаемости мотонейронов [9]. Его вводят однократно с помощью внутривенной инфузии.
- Спинраза (Нусинерсен) и Эврисди (Рисдиплам) — помогают гену SMN2 производить больше белка и таким образом компенсируют дефицит, вызванный мутацией в гене SMN1 [9][10]. Эврисди принимают внутрь ежедневно в течение всей жизни. Спинразу вводят посредством люмбальной пункции (через поясничный прокол) несколько раз в течение первых месяцев лечения. Дальнейшую периодичность определяет врач.

Люмбальная пункция
Главная цель лечения — остановить процесс гибели мотонейронов в спинном мозге и сохранить максимально возможный объём мышц и мобильность пациента. Препараты, указанные выше, применяют всего несколько лет, но они уже показывают значительные результаты: дети с СМА 1-го типа могут сидеть, а в некоторых случаях даже ходить (с поддержкой или самостоятельно). Пациенты с установленным генетическим диагнозом, которые получили лечение в досимптомном периоде, двигаются так же, как и здоровые люди [10][11]. Поэтому скрининг новорождённых имеет огромное прогностическое значение, так как вовремя установленный диагноз снижает детскую инвалидизацию и смертность [6][7].
Показания к приёму Золгенсма:
- СМА 1-го типа c подтверждённой мутацией в обоих аллелях гена SMN1;
- количество гена SMN2 не превышает 3 копий;
- вес пациента до 21 кг.
У Эврисди и Спинраза нет ограничений по весу и дебюту заболевания [2]. Тем не менее чаще всего лечение направлено на детей, поэтому сейчас нет данных о результатах приёма генных препаратов пациентами старше 65 лет.
Важно отметить, что генная терапия является дорогостоящим методом лечения, который финансируется из разных источников, включая государственные программы. Терапию СМА детям оплачивает фонд «Круг добра», созданный президентом России в 2021 году. Когда у ребёнка диагностируют такое заболевание, фонд оплачивает любой из трёх препаратов, назначенный врачами.
Симптоматическое лечение
Всем пациентам с СМА как до генной терапии, так и после неё, показана лечебная физкультура (ЛФК). Занятия разрабатывают индивидуально в зависимости от имеющегося неврологического статуса, респираторных и других осложнений [2].
К симптоматической терапии также относится:
- поддержка дыхательной системы — при необходимости пациенту обеспечивают неинвазивную вентиляцию лёгких или устанавливают трахеостому;
- поддержка нутритивного статуса — для этого используют зонды и гастростому;
- хирургическая коррекция ортопедических осложнений (сколиоза, контрактур, деформаций суставов);
- обезболивание;
- восполнение дефицита нутриентов и витаминов.
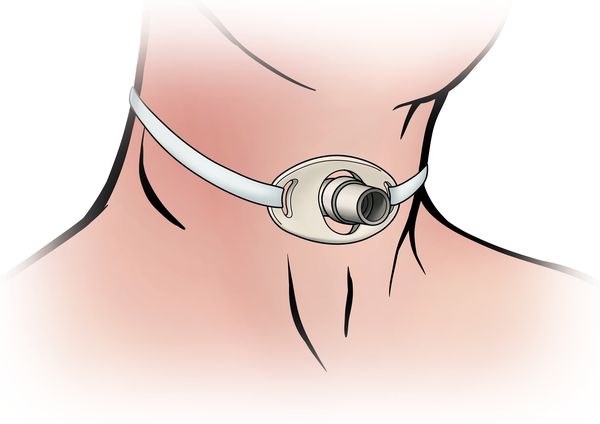
Трахеостомия
Лечение может проводиться амбулаторно или в стационаре. Госпитализация в стационар может быть плановой, если пациенту показана диагностика, реабилитация, введение генных препаратов, хирургическое вмешательство (в том числе гастро- и трахеостомия), или экстренной, когда больной нуждается в немедленном вмешательстве при остро возникшем состоянии, например при острой инфекции, хирургической патологии или травме.
Важно отметить, что лечением пациентов с СМА занимается мультидисциплинарная команда, которая включает в себя неврологов, педиатров, хирургов, пульмонологов, анестезиологов-реаниматологов, а также диетологов, гастроэнтерологов и психологов [2].
Прогноз. Профилактика
Без лечения заболевание будет неизбежно прогрессировать: чем больше погибает мотонейронов, тем слабее становятся мышцы. В дальнейшем в патологический процесс вовлекается дыхательная мускулатура. В этом случае большинство детей с СМА 1-го типа не доживает и до двух лет.
Повысить шанс благоприятного исхода помогает своевременная диагностика и лечение. Терапия считается эффективной, когда новые мышцы не вовлекаются в процесс атрофии, частично восстанавливаются утраченные ранее движения и не появляются новые нарушения. Генные препараты позволяют пациентам с СМА 1-го типа жить обычной жизнью, хотя в ряде случаев могут потребоваться специальные средства для адаптации к условиям внешней среды, например трости или костыли, а также занятия ЛФК. Благоприятные исходы подтверждаются не только очевидным улучшением здоровья по сравнению с теми детьми, которые никогда не получали лечение, но и лабораторными исследованиями [6][15][17].
Важно отметить, что прямого воздействия на репродуктивную систему у СМА нет, однако приём некоторых препаратов при этом заболевании влияет на способность зачать ребёнка, например Рисдиплам может снизить мужскую фертильность, однако после его отмены этот эффект проходит [2].
Профилактика спинальной амиотрофии Верднига — Гоффмана
Чтобы снизить риск рождения ребёнка с СМА, при планировании беременности необходимо пройти медико-генетическое исследование гена SMN1 у плода (или эмбриона при ЭКО), если:
- будущие родители являются носителями мутации гена SMN1;
- в семьях родителей есть случаи СМА;
- в семье была гибель ребёнка в раннем возрасте без установленной причины.
Также исследование гена SMN1 может быть полезным для бессимптомных братьев и сестёр заболевшего ребёнка, чтобы в случае выявления мутации в двух копиях гена, быстрее приступить к лечению и минимизировать будущие проявления болезни [7].
Список литературы
Verhaart I. E. C., Robertson A., Wilson I. J. et al. Prevalence, incidence and carrier frequency of 5q–linked spinal muscular atrophy — a literature review // Orphanet J Rare Dis. — 2017. — № 1. — P. 124. ссылка
Всероссийское общество неврологов. Проксимальная спинальная мышечная атрофия 5q: клинические рекомендации. — М., 2023. — С. 9–37.
Brambilla L., Valori C. F., Guidotti G. et al. Recombinant SMN protein synergizes with spinal muscular atrophy therapy to counteract pathological motor neuron phenotypes // Transl Neurodegener. — 2024. — № 1. — P. 63. ссылка
Nishio H., Niba E. T. E., Saito T. et al. Spinal Muscular Atrophy: The Past, Present, and Future of Diagnosis and Treatment // Int J Mol Sci. — 2023. — № 15. — P. 11939.ссылка
Glanzman A. M., Mazzone E., Main M. et al. The Children's Hospital of Philadelphia Infant Test of Neuromuscular Disorders (CHOP INTEND): test development and reliability // Neuromuscul Disord. — 2010. — № 3. — P. 155–161. ссылка
de-Andrés-Beltrán B., Güeita-Rodríguez J., Palacios-Ceña D. et al. Clinical and Functional Characteristics of a New Phenotype of SMA Type I among a National Sample of Spanish Children: A Cross-Sectional Study // Children. — 2023. — № 5. — P. 892.ссылка
Schroth M., Deans J., Arya K. et al. Spinal Muscular Atrophy Update in Best Practices: Recommendations for Diagnosis Considerations // Neurol Clin Pract. — 2024. — № 4. — P. e200310. ссылка
Prior T. W., Spaulding T. M., Barohn R. J. Spinal Muscular Atrophy // GeneReviews. — 2024.ссылка
Ogbonmide T., Rathore R., Rangrej S. B. et al. Gene Therapy for Spinal Muscular Atrophy (SMA): A Review of Current Challenges and Safety Considerations for Onasemnogene Abeparvovec (Zolgensma) // Cureus. — 2023. — № 3. — P. e36197. ссылка
Влодавец Д. В. Рисдиплам при лечении спинальной мышечной атрофии // Журнал неврологии и психиатрии им. С. С. Корсакова. — 2024. — № 2. — С. 45–57.
Клюшников С. А., Иллариошкин С. Н. Эффективность и безопасность Нусинерсена при спинальной мышечной атрофии у взрослых // Нервные болезни — 2023. — № 1. — С. 3–14.
Güzin Y., Büyükşen O., Gençpınar P. et al. Common complications in spinal muscular atrophy (SMA) type 1 after nusinersen treatment // Turk J Pediatr. — 2024. — № 5. — P. 567–577. ссылка
Lagae L., Proesmans M., Van den Hauwe M. et al. Respiratory morbidity in patients with spinal muscular atrophy — a changing world in the light of disease-modifying therapies // Front Pediatr. — 2024. — Vol. 12. — P. 1366943.ссылка
Wijngaarde C. A., Blank A. C., Stam M. et al. Cardiac pathology in spinal muscular atrophy: a systematic review // Orphanet J Rare Dis. — 2017. — № 1. — P. 67. ссылка
Badina M., Mirea A., Sporea C. et al. Predictive Clinical-Biological Markers Over the First 3 Years of Nusinersen Treatment in SMA Type 1 Patients // Balneo PRM Res J. — 2024. — № 4. — P. 754.
Madakshira M. G., Singla S., Gupta K. et al. Autopsy of a child with Spinal muscular atrophy Type I (Werdnig-Hoffmann disease) // Autops Case Rep. — 2020. — № 2. — P. E2020157.ссылка
Фисенко Д. А., Кузенкова Л. М., Куренков А. Л. и др. Нейрофиламенты как биомаркер спинальной мышечной атрофии // Неврологический журнал имени Л. О. Бадаляна. — 2023. — № 3. — С. 130–136.
Angelini C. Genetic Neuromuscular Disorders: A Case-Based Approach. — Cham: Springer, 2017. — Р. 341–343.

