Определение болезни. Причины заболевания
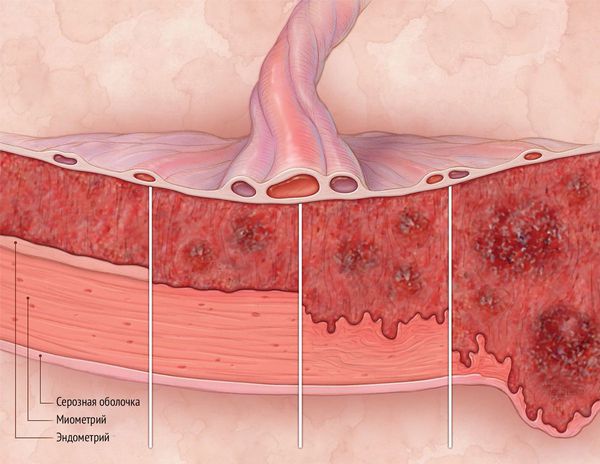
Синдром Ашермана — это заболевание, при котором происходит сращение стенок матки между собой и возникают внутриматочные спайки (синехии).
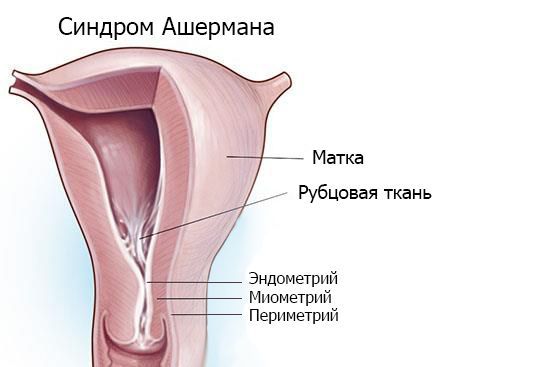
Внутриматочные сращения — синдром Ашермана
Впервые заращение полости матки после выскабливания (по причине послеродового кровотечения) упомянул немецкий гинеколог и акушер Генрих Фритч в 1894 году [1]. Позднее, в 1948-1950 гг., заболевание подробно описал Джозеф Ашерман, в честь которого и был назван синдром. Ашерман обнаружил, что у некоторых больных после повторных выскабливаний возникают сращения полости матки или внутреннего зева и исчезают менструации. Это состояние он назвал травматической аменореей [2][3].
Основная причина патологии — травма эндометрия, особенно на фоне инфекции, которая ведёт к воспалению в полости матки и формированию спаек. Наиболее опасны выскабливания между второй и четвёртой неделей после родов.
Примерно в 90 % случаев синдром Ашермана возникает в результате постабортных или послеродовых вмешательств [4]. В 40 % случаев спайки образуются после повторных выскабливаний при неполном аборте и удалении остатков плацентарной ткани [5]. Нередко сращения возникают после гистероскопических вмешательств по удалению субмукозных узлов — доброкачественных образований в подслизистом слое матки. Удаление сразу нескольких узлов повышает вероятность образования спаек [6].
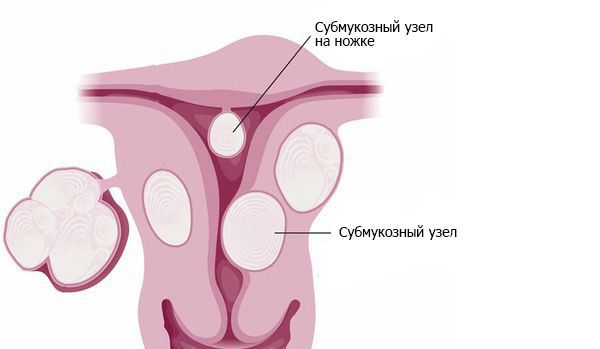
Субмукозные узлы
Синдром Ашермана иногда встречается после наложения шва Линча (процедура для остановки послеродового кровотечения) и после эмболизации маточных артерий (операции по искусственной закупорке сосудов). К редким причинам относят воспаление половых органов при использовании внутриматочной спирали, генитальном туберкулёзе и шистоматозе (токсико-аллергическом заболевании, вызванном гельминтами).
Симптомы синдрома Ашермана
Как правило, женщины самостоятельно замечают заболевание, когда после медицинского аборта или другой внутриматочной процедуры менструации стали скудными (гипоменоррея) или исчезли совсем (аменорея) [8]. Вместо них внизу живота возникают схваткообразные интенсивные боли, вызванные затруднением оттока менструальной крови. Эти боли появляются каждый месяц, соответствуя фазе менструального цикла, однако выделений при этом нет. К другим симптомам синдрома относят:
- бесплодие;
- выкидыши;
- нарушение плацентации (врастание плаценты и её предлежание) [9];
При патологии кровь скапливается главным образом не в матке (поскольку там нет свободного пространства из-за сращения), а в маточных трубах. Всасывание менструальной крови может приводить к повышению температуры до субфебрильных величин (чуть больше 37°).
Патогенез синдрома Ашермана
Внутриматочные сращения возникают в ответ на травму или удаление эндометрия противоположных стенок полости матки. После травмы в считаные минуты начинается острое воспаление. Воспалительный процесс активирует комплекс биохимических реакций, похожих на те, которые возникают при кровотечении:
- Тромбоциты прилипают к повреждённой поверхности.
- Местный кровоток усиливается, расширяются мелкие сосуды, по которым течёт артериальная кровь (артериолы).
- Клетки, которые помогают организму бороться с воспалением (нейтрофилы и макрофаги), перемещаются к месту травмы.
- Формируется фибриновая плёнка. Поначалу она тонкая, как паутинка, и располагается в зонах, поверхность которых наиболее повреждена, чаще в месте перехода шейки в тело матки (область внутреннего зева), хотя может покрывать и всю полость матки.
- На третий день после травмы начинают расти клетки, формирующие соединительнотканный рубец, а на пятый в фибриновой плёнке развивается сосудистая сеть, что неотвратимо ведёт к образованию сращений в полости матки [7].
Таким образом, сращения можно обнаружить на пятый день после вмешательства. Следует отметить, что фибриновая плёнка появляется после травмы у всех пациентов — это защитная реакция организма для ограничения повреждённого участка. У многих женщин к пятому дню плёнка рассасывается, и они выздоравливают, но у части запускается процесс образования спаек.
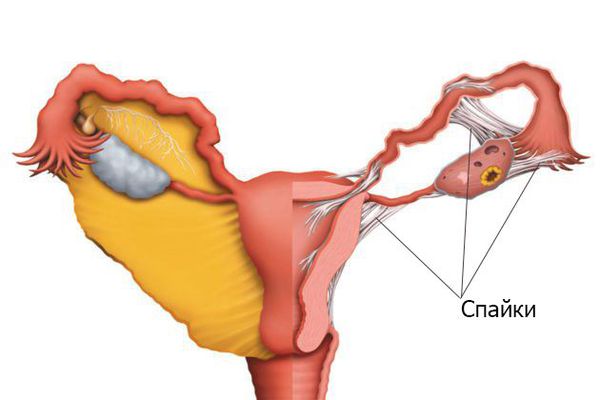
Спайки в маточных трубах
Формирование спаек зависит от степени травмы, состояния иммунной системы, врождённых особенностей и других факторов, многие из которых непонятны до сих пор. Развитию патологии способствуют:
- наличие сгустков крови или остатков плодного яйца в полости матки, что является хорошей питательной средой для микробов;
- заболевания, передающиеся преимущественно половым путём;
- ослабленный иммунитет;
- перенесённое в прошлом вмешательство на шейке матки, ухудшившее её барьерную функцию и другие факторы.
Классификация и стадии развития синдрома Ашермана
Существует несколько классификаций синдрома Ашермана. Одна из самых простых и удобных — классификация по March (2011), который разделял внутриматочные сращения на 3 группы:
- Умеренные — нежные и тонкие спайки, которые занимают менее 25 % полости матки. Устья маточных труб и дно матки свободны или минимально вовлечены.
- Средние — спайками покрыто от 25 до 75 % полости матки, устья маточных труб и дно частично заращены;
- Выраженные — дно и устья маточных труб полностью заращены, спайками покрыто более 75 % полости матки [10].
Степени развития заболевания более подробно рассмотрены в классификации European Society of Gynecological Endoscopy (1995) [11].
Степень | Распространённость внутриматочных спаек |
|---|---|
| 1 | - тонкие и/или плоскостные спайки в устьях маточных труб, которые легко разрушаются тубусом гистероскопа; |
2а | - единичные плотные сращения соединяют противоположные зоны полости матки; - устья маточных труб визуализируются; - спайки не могут быть разделены тубусом гистероскопа. |
| 2б | - полное заращение внутреннего зева, при этом верхняя часть полости матки выглядит нормально; |
| 3 | - множественные плотные сращения соединяют противоположные зоны полости матки; - устье одной маточной трубы полностью заращено; |
| 4 | - выраженные плотные сращения с частичным заращением полости матки и устьев обеих маточных труб; |
5а | -выраженное рубцевание и разрастание или замещение плотной соединительной тканью внутреннего слоя матки в сочетании со спайками 1 или 2 степени; - аменорея или выраженная гипоменорея; |
| 5б | - выраженное рубцевание и фиброз эндометрия в комбинации со спайками 3 или 4 степени; - аменорея. |
По классификации Американского Общества Репродуктивной Медицины оцениваются данные рентгенодиагностики маточных труб (гистеросальпингографии), гистероскопии, тип спаек, степень нарушений менструальной функции и формируется долгосрочный прогноз по возможности зачать и выносить ребёнка [12].
| Степень вовлечения полости матки | Менее 1/3 – 1 балл | 1/3-2/3 – 2 балла | 2/3 – 4 балла |
|---|---|---|---|
| Тип спаек | Нежные – 1 балл | Нежные и плотные – 2 балла | Плотные – 4 балла |
| Нарушение менструаций | Норма – 0 баллов | Гипоменоррея – 2 балла | Аменорея – 4 балла |
Суммируя баллы, выделяют 3 стадии:
- слабая — 1-4 балла;
- средняя — 5-8 баллов;
- тяжёлая — 9-12 баллов.
Осложнения синдрома Ашермана
Заболевание может вызывать следующие осложнения:
1. Бесплодие. Беременность возможна только после удачно проведённой операции, при которой удаётся восстановить полноценный объём полости матки и освободить устья маточных труб.
2. Циклические ежемесячные боли. Возникают при заращивании внутреннего зева и нижней трети полости матки.
3. Эндометриоз. Выражается в том, что клетки эндометрия (внутреннего слоя стенки матки) разрастаются за пределами этого слоя. Согласно имплантационной теории, заболевание вызвано тем, что большое количество менструальной крови через маточные трубы попадает в брюшную полость. Отток во влагалище при этом затруднён. Обилие крови в брюшной полости приводит к тому, что защитные силы организма не успевают подавлять активность и разрушать клетки эндометрия.
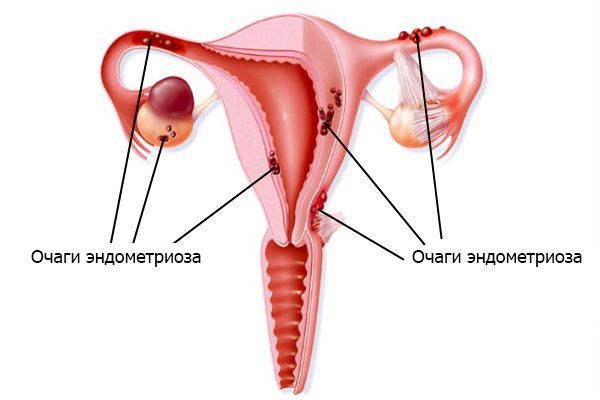
Очаги эндометриоза
4. Невынашивание беременности, выкидыши. Основная причина состоит в том, что сращения ограничивают функциональный объём полости матки и не дают ей растягиваться.
5. Гипоменструальный синдром (скудные менструации — 1-2 дня, меньше 25 мл, а порой несколько дней в виде "мазни"). Возникает при частичном заращении полости матки.
6. Неправильное прикрепление (врастание в стенку матки) плаценты. Осложнение проявляется, когда плацента не отделяется после родов. Это может вызвать кровотечение и в ряде случаев приводит к удалению матки.
Степени врастания плаценты
Диагностика синдрома Ашермана
Основные методы диагностики:
- Диагностическая гистероскопия. Метод позволяет визуально оценить степень поражения эндометрия и является золотым стандартом выявления синдрома Ашермана [13].
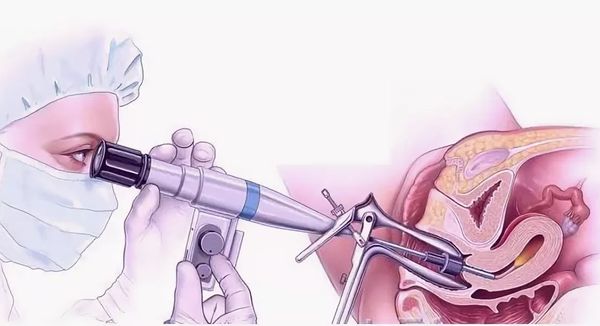
Диагностическая гистероскопия
- Гистеросальпингография — исследование, при котором в полость матки вводят рентгеноконтрастный раствор и выполняют рентгеновские снимки для получения изображения полости матки и просвета маточных труб. Имеет лишь историческое значение, потому что точность метода невелика, а лучевая нагрузка на гениталии существенна. Облучение может спровоцировать злокачественные заболевания половых органов или ухудшить работу яичников.
- Зондирование полости матки — метод гинекологического исследования, который проводят с помощью специального маточного зонда.
- Ультразвуковое исследование. Если есть спайки, то на снимках видны эхогенные, нерегулярные эксцентричные линейные сигналы — беловатые плотные участки рубцовой ткани или локальное истончение эндометрия. Исследование проводят в лютеиновую фазу (период с момента овуляции и до начала менструаций).
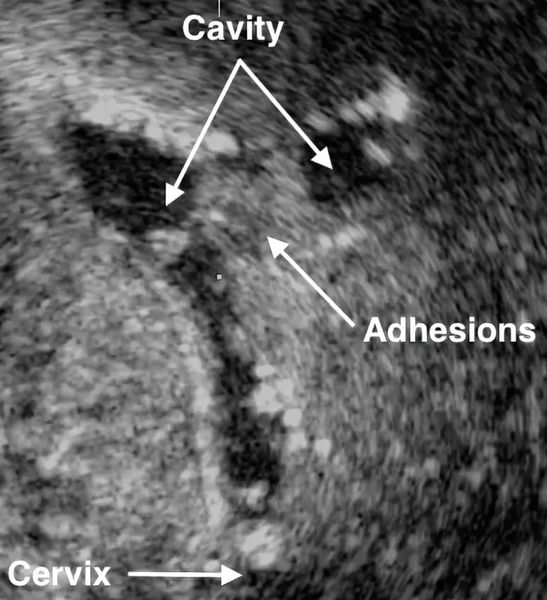
Ультразвуковое изображение внутриматочных спаек.
- Соногистерография — ультразвуковое исследование, во время которого в полость матки вводят физиологический раствор.
- Допплеровское исследование — ультразвуковая оценка органических изменений, нарушающих кровоток. Метод позволяет оценить функциональное состояние эндометрия.
- Магнитно-резонансная томография — применяется в случаях тотального поражения полости матки при невозможности провести гистероскопию.
Гистероскопия является самым точным и надёжным методом диагностики синдрома Ашермана. Другие техники выполняют вспомогательное значение и часто дают противоречивые результаты при субмукозных миомах (узлах, растущих в полость матки) и при гиперпластических процессах эндометрия.
Лечение синдрома Ашермана
Операция показана при бесплодии, невынашивании беременности и циклические болях, возникающих из-за затруднения оттока менструальной крови. В последнем случае цель операции состоит в удалении жидкого содержимого из полости матки.
Первые попытки лечить синдром Ашермана заключались в проведении лапаротомии (операции, которая производится путем рассечения передней брюшной стенки скальпелем), утеротомии (рассечении стенки матки) и пальцевом разрушении спаек. Данные методики имеют лишь историческое значение, поскольку появление гистероскопии значительно улучшило результаты терапии.
Перед операцией, как правило, проводят профилактическое лечение антибиотиками широкого спектра действия. Цель операции — полностью восстановить полость матки. К сожалению, при обширном поражении часто невозможно обнаружить устья маточных труб и найти правильное направление для рассечения сращений. Тогда задача состоит в создании объёма полости матки, достаточного для применения методов вспомогательной репродукции.

Перед операцией
Важные аспекты хирургического вмешательства:
- За несколько минут до операции проводят трансвлагалищное УЗИ, чтобы чётко представлять изгиб полости матки. Для навигации в сложных случаях используют ультразвук и лапароскопию, хотя эти методы не могут гарантированно предотвратить разрыв стенок матки, если хирург потеряет правильное направление при рассечении сращений.
- Рассечение сращений производят от центра полости матки латерально (в боковую сторону) и в сторону устьев маточных труб. Рубцовая ткань, в отличие от миометрия, не кровоточит — это является критерием правильности выбранного курса.
- Часто достаточно рассечь плотные сращения в области внутреннего зева и нижней трети полости матки. Это поможет получить доступ ко дну матки, где сращения обычно не очень плотные, и без затруднений освободить устья маточных труб.
Если операция прошла удачно и пациентка чувствует себя хорошо, то уже вечером она может быть выписана. Если процедура была сложной или потребовалось проведение лапароскопии, придётся провести ночь в стационаре.
Прогноз. Профилактика
Прогноз не всегда благоприятен, поэтому особое внимание следует обратить на профилактические меры. Их можно разделить на две группы:
1. Методы первичной профилактики развития спаек в полости матки:
- Бережное отношение к матке при выскабливании, снижение числа повторных вмешательств. Этого можно добиться применением гемостатиков (препаратов, останавливающих кровотечение) после абортов, что уменьшит риск повторного выскабливания. При наличии остатков плодного яйца в полости матки не следует торопиться с выскабливанием, так как 95 % плацентарных полипов (остатков беременности) спонтанно разрушаются в течение трёх месяцев на фоне приёма оральных контрацептивов. Если же повторное опорожнение полости матки необходимо, то выполнить это можно деликатно: методом вакуум-аспирации при ультразвуковой навигации.
- Чтобы предотвратить развитие спаек после внутриматочной хирургии следует ограничить использование электрохирургии в пользу методики Cold Loop ("Холодная петля"). Технология заключается в том, что при удалении субмукозных узлов 1 и 2 типов (когда часть узла находится в полости матки, а часть в стенке) часть узла в матке постепенно удаляется по кусочкам с помощью высокотемпературной петли. Далее узел извлекается из стенки матки с помощью специальных механических устройств, при этом миометрий сокращается и выталкивает остатки узла в просвет полости матки. Очень важно при этом находиться в правильном слое — между псевдокапсулой (растянутыми тканями матки, покрывающими миоматозный узел) и самой миомой. Это позволяет бескровно выделить узел из ложа и обойтись без прижигания тканей, либо использовать её в минимальном объёме на последнем этапе[15]. Это очень важно, поскольку на обожжённой поверхности полости матки легко образуются спайки, а эндометрий восстанавливается очень медленно, да и высокая температура может повредить нижележащий слой миометрия и возникает риск разрыва матки при последующей беременности.
2. Вторичная профилактика — комплекс мер, направленных на снижение риска повторного появления спаек в полости матки после их рассечения:
- После рассечения спаек для стимуляции роста эндометрия следует принимать эстрогены и ввести в полость матки гелевый противоспаечный агент [16][17]. Гель позволяет временно, на пять суток, разобщить противоположные стенки матки и не дать им срастись.
- Применение катетера Фолея (трубки для выведения мочи из мочевого пузыря) — заполненный катетер разобщает стенки матки, он может находиться в полости матки до двух недель. С этой же целью применяют различные пластиковые устройства и внутриматочные спирали. Вероятность повторного образования спаек снижается, но остаётся риск инфицирования [18].
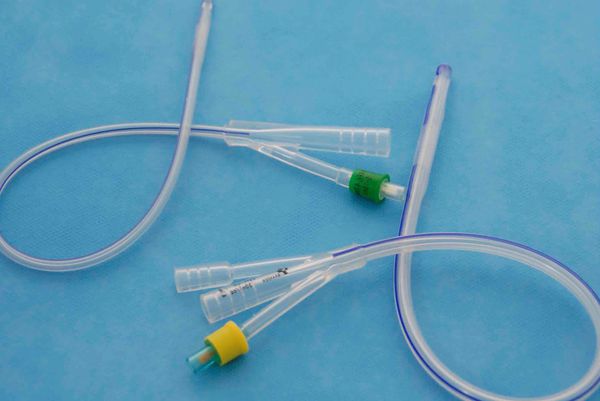
Катетер Фолея
- Согласно последним исследованиям, для регенерации эндометрия перспективно применение стволовых клеток [20].
Несмотря на профилактику спаек, они повторно образуются у 25 % женщин с умеренной степенью синдрома Ашермана и у 75 % с тяжёлой. Беременность наступает у 25-75 % оперированных женщин, доношенные дети рождаются в 26-79 % случаях. Разница в данных связана с тем, что не существует общепризнанной классификации синдрома и единого подхода ко вторичной профилактике заболевания.
В дополнение к вышеперечисленным методикам в послеоперационном периоде используют программируемую газовую дистензию. Метод заключается в том, что для разобщения стенок полость матки заполняют углекислым газом. Под давлением газа полость матки растягивается, что приводит к разрушению нежных спаек. Процедуру проводят последовательно на 3, 7 и 10 день после операции. Дополнительным преимуществом является то, что газ, в отличие от жидкости, не переносит в полость матки микроорганизмы, находящиеся на шейке, это делает процедуру более безопасной.
Список литературы
Fritsch H. A case of complete atrophy of the uterine cavity after curettage. Zentrabl. Gynacol, 1894. — 18: 1337-9.
Asherman J. G. Amenorrhoea traumatica (atretica) // The Journal of Obstetrics and Gynecology of the British Empire, 1948; 55: 22-30.ссылка
Asherman J. G. Traumatic intra-uterine adhesions // The Journal of Obstetrics and Gynecology of the British Empire, 1950; 57 (6): 892-896.ссылка
Al-Inany H. Intrauterine adhesions. An update //Acta Obstet Gynecol Scand, 2001; 80: 986-993.ссылка
Westendorp I. C, Ankum W. M, Mol B. W, Vonk J. Prevalence of Asherman’s syndrome after secondary removal of placental remnants or a repeat curettage for incomplete abortion // Hum Reprod, 1998; 13(12): 3347–3350.ссылка
Taskin O., Sadik S., Onoglu A., et al. Role of endometrial suppression on the frequency of intrauterine adhesions after resectoscopic surgery // J Am Assoc Gynecol Laparosc, 2000; 7(3): 351–354.ссылка
Koninckx P. R., Gomel V., Ussia A., Adamyan L. Role of peritoneal cavity in the prevention of postoperative adhesions, pain and fatigue // Fertil Steril, 2016; 106: 998-1010.ссылка
Schenker J. G., Margalioth E. J. Intrauterine adhesions: an updated appraisal // Fertil Steril, 1982; 37: 593-610.ссылка
Engelbrechtsen L., Langhoff-Ross J., et al. Placenta accreta: adherent placenta due to Asherman syndrome // Clin. Case Rep, 2015; 3(3): 175-178.ссылка
March C. M. Management of Asherman’s syndrome // Reproductive biomedicine online, 2010. ссылка
Wamsteker K., De Block S. J. Diagnostic hysteroscopy: technique and documentation // Endoscopic Surgery for Gynecologists. NY: Lippincott Williams & Wilkins Publishers, 1995; 263-276.
. The American Fertility Society classifications of adnexal adhesions, distal tubal occlusion secondary to tubal ligation, tubal pregnancies, mullerian anomalies and intrauterine adhesions // Fertil Steril, 1988; 49: 944-955.ссылка
Dreiser E., Kjer J. J. Asherman`s syndrome: current perspectives on diagnosis and management // Int. Journal of Women`s Health, 2019; 11:191-198.ссылка
Protopapas A., Shushan A., Magos A. Myometrial scoring: a new technique for the management of severe Assherman’s syndrome // Fertil Steril, 1998; 69(5): 860-864.ссылка
Mazzon I., Favilli A., Cocco P., et al. Does cold loop hysteroscopic myomectomy reduce intrauterine adhesions? A retrospective study // Fertil Steril, 2014; 101(1): 294–298.ссылка
Acunzo G., Guida M., Pellicano M., et al. Effectiveness of auto-crosslinked hyaluronic acid gel in prevention of intrauterine adhesions after hysteroscopic adhesiolysis: a prospective, randomized, controlled study // Hum. Reprod, 2003; 18: 1918-1921.ссылка
Verguts J., Bosteels J., et al. Belgian consensus on adhesion prevention in hysteroscopy and laparoscopy // Gynecological Surgery, 2015; 12: 179-187.
Anti-adhesion therapy following operative hysteroscopy for treatment of female subfertility. Cohrane Database of Systematic Reviews, 2017. ссылка
Xu W., Zhang Y., Yang Y., Zhang S., Lin X. Effect of early second-look hysteroscopy on reproductive outcomes after hysteroscopic adhesiolysis in patients with intrauterine adhesion, a retrospective study in China // Int J Surg, 2018; 50: 49–54.ссылка
Tan J., Wang Q., et al. Autologus menstrual blood-derived stromal cells transplantation for severe Asherman`s syndrome // Hum. Reprod, 2016; 31 (12): 2723-2729ссылка
21. Макаренко Т. А., Никифорова Д. Е. Современные возможности в лечении синдрома Ашермана // Русский медицинский журнал. Мать и дитя. — 2016. — № 15. — С. 1001-1004.

