Определение болезни. Причины заболевания
Плоскоклеточный рак лёгкого (Squamous cell lung cancer) — это вариант рака лёгкого, который развивается из метаплазированного (изменённого) эпителия, выстилающего внутреннюю поверхность бронхов.
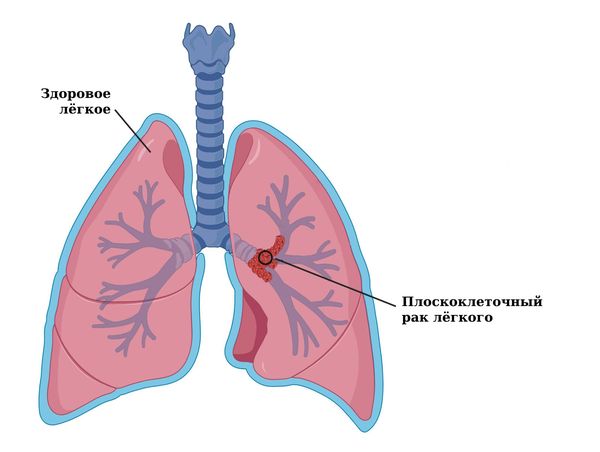
Плоскоклеточный рак лёгкого
Плоскоклеточным его назвали потому, что нормальный призматический эпителий бронхов на фоне постоянного воспаления со временем становится плоским. Такой процесс замены клеток одного типа на другой называют метаплазией. Со временем на фоне этой метаплазии в бронхах развивается плоскоклеточный рак лёгкого.
Это самый распространённый гистологический (связанный с типом тканей) вариант рака лёгкого.
Начало заболевания проявляется кровохарканием и/или сильным кашлем, который не проходит после лечения стандартными препаратами от кашля.
Причины и факторы риска
Один из факторов, который значительно повышает риск возникновения рака лёгких, — это курение. С ним связано абсолютное большинство случаев плоскоклеточного рака лёгкого: примерно 80 % случаев у мужчин и 90 % — у женщин [1][19].
Альтернативные варианты курения (электронных сигарет, вейпов, кальянов) тоже пагубно влияют на организм, но оценить риск развития рака от них невозможно, так как пока недостаточно научных исследований и данных по этому вопросу [32].
Помимо курения, факторами риска развития плоскоклеточного рака лёгкого могут быть химическое повреждения эпителия бронхов и хронические заболевания дыхательных путей (пневмокониозы, хронический бронхит, пневмония и т. д.), которые приводят к дисплазии (изменению строения) и метаплазии эпителия дыхательных путей [30].
Распространённость
В России рак лёгких, в том числе плоскоклеточный, у мужчин выявляется в 3,5 раза чаще, чем у женщин. В основном болезнь диагностируют у людей в возрасте 65 лет и старше [29][31].
Из-за плоскоклеточного рака лёгких в год погибает около 400 000 пациентов во всем мире. В России ежегодно умирает около 50 тысяч человек [2][29].
Симптомы плоскоклеточного рака лёгкого
При плоскоклеточном варианте симптомы обычно появляются раньше, чем при других вариантах и подтипах рака лёгкого. Это связано с тем, что он чаще поражает крупные бронхи (прорастает в них или растёт в их просвет). Такое расположение опухоли называют центральным [3].
Типичные симптомы при плоскоклеточном раке лёгкого:
- Постоянный кашель с мокротой или без, который не проходит более 2–4 недель, несмотря на лечение препаратами от кашля. Он возникает из-за раздражения рецепторов стенки бронха.
- Одышка — учащённое дыхание в покое или при минимальной физической активности.
- Кровохаркание. Появляется при прорастании опухоли в крупный бронх.
- Выраженная общая слабость.
- Боли в грудной клетке, не связанные с травмой и положением тела. Возникают при прорастании опухоли в париетальную плевру (оболочку, которая покрывает внутреннюю поверхность грудной полости) и рёбра.
- Осиплость голоса. Может беспокоить при поражении внутригрудных лимфоузлов и сдавлении возвратного нерва, который отвечает за движение и чувствительность голосовых связок.
- Потеря веса за короткий промежуток времени без изменения рациона и образа жизни.
- Боли в одной или нескольких костях. Появляются при прорастании опухоли в кости или появлении в них метастазов.
- Головные боли или острая неврологическая симптоматика: головокружение, нарушение речи (несвязность, спутанность слов), странности поведения, полный или частичный паралич рук и/или ног и т. д.
- Паранеопластический синдром. Это группа редких состояний, возникающих из-за того, что опухоль выделяет в кровь активные вещества, специфически влияющие на организм. Синдром может включать нарушения работы эндокринной системы, кожные проявления, а также гематологические (анемию и т. п.), желудочно-кишечные (энтеропатии, снижение аппетита и т. д.), нефрологические, скелетно-суставные, неврологические и др. [5][20]
Иногда симптомы проявляются довольно поздно или они незначительны, поэтому пациент не придаёт им должного значения [4]. В таком случае явные симптомы возникают, когда заболевание уже распространилось по организму.
Патогенез плоскоклеточного рака лёгкого
Плоскоклеточный рак лёгкого чаще всего связан с курением табака, поэтому рассмотрим, как именно курение влияет на работу дыхательных путей и развитие патологии.
Трахея и бронхи состоят из хрящевых колец и соединительной ткани с гладкомышечной мускулатурой между ними. В просвете дыхательных путей находится мерцательный эпителий, который в норме выполняет защитную функцию — слизь эпителия увлажняет поверхность бронхов и защищает их от механического, инфекционного и другого воздействия, так как частицы пыли, бактерии и другие инородные частицы оседают в этой слизи и не проникают в организм. Также мерцательный эпителий продвигает слизь с осевшими на неё инородными частицами от периферии к центру (трахее), чтобы в дальнейшем вывести её из дыхательных путей в виде мокроты.

Строение лёгких
При постоянном курении на эпителий воздействуют агрессивные химические соединения — монооксид углерода, ацетальдегид, формальдегид, акролеин и другие карбонилы, а также никотин и специфические для табака нитрозамины [6]. Эти патогенные для организма химические соединения нарушают нормальную работу эпителия, уменьшают местный иммунитет, т. е. ослабляют защиту бронхов и снижают их активность. В перерывах между курением, когда никотин не попадает в организм, мокрота хуже отходит из дальних мелких бронхов (бронхиол), застаивается, в результате возникают благоприятные условия для патогенных и условно-патогенных бактерий, что приводит к частым бронхитам [7]. Именно поэтому среди курильщиков хронический бронхит встречается значительно чаще, чем у некурящих людей.
При хроническом, как и при остром, воспалении клетки повреждаются, им требуется «ремонт» и «обновление». Такой процесс называется клеточной репарацией. При этом происходит клеточная пролиферация — размножение клеток путём их деления, при котором появляются нормальные клетки, подобные остальным [8]. При постоянном пагубном воздействии химических веществ от курения или других вредных факторов (асбеста, химических реактивов на работе и т. д.) эта пролиферация происходит гораздо чаще. Создание клеточной структуры ДНК может происходить с ошибками из-за нарушения нормального взаимодействия белков-строителей клетки.
Для развития опухолевой злокачественной клетки должно произойти от 5 до 9 мутаций ДНК, которые нарушат её клеточный ответ, структуру и нормальную функцию деления [9]. Никто не знает, когда произойдут эти мутации и произойдут ли вовсе, однако у людей, которые курят и страдают хроническими воспалительным заболеваниями лёгких (например, хроническим бронхитом), риск мутаций выше из-за постоянной репликации (воспроизведения) и деления клеток с необходимостью синтеза ДНК. Рано или поздно ошибки в ДНК могут стать причиной начала онкогенного процесса.
После того, как появилась первая опухолевая клетка, она начинает активно делиться и не отвечает на сигнал организма остановиться. Это связано с тем, что в опухолевых клетках нет рецепторов и белков, отвечающих за апоптоз (программируемую смерть клетки) [10]. Если иммунитет человека слаб или «не видит» опухолевые клетки по разным причинам, то они размножаются достаточно быстро и развивается злокачественное новообразование, которое и называют «рак» [11].
Метастазирование
Если опухоль достигает определённой массы и размера и у неё есть питающие кровеносные и лимфатические сосуды, опухолевые клетки попадают в кровеносное русло или лимфатический проток. Если, попав в кровь или лимфу, эти клетки выжили и сумели имплантироваться в новом месте, то они могут остаться там в состоянии «сна» в составе нескольких клеток (микрометастазов) или развиваться дальше с образованием макрометастазов.
Природа и строение метастазов такие же, как и у первичной опухоли, поэтому системная лекарственная противоопухолевая терапия будет действовать сразу на все новообразования.
Классификация и стадии развития плоскоклеточного рака лёгкого
Плоскоклеточный рак лёгкого является одним из гистологических подтипов рака лёгкого, наряду с аденокарциномой, мелкоклеточным и крупноклеточным раком.
Чаще всего плоскоклеточный рак лёгкого растёт из крупных бронхов (главных и долевых), т. е. является центральным.
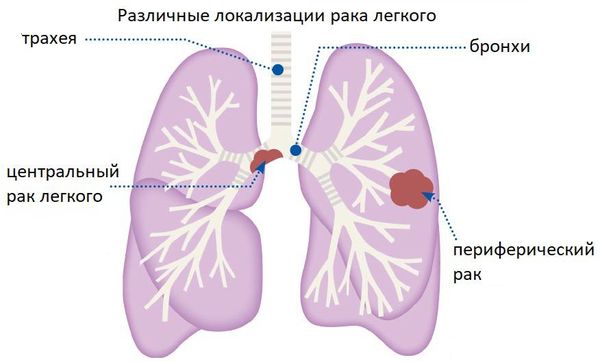
Типы рака лёгкого по расположению
Встречаются и более редкие формы: рак Панкоста и медиастинальная форма рака.
У рака Панкоста наблюдаются специфические симптомы:
- синдром Панкоста — боль и слабость в руке на стороне развития рака лёгкого с последующей атрофией руки, т. е. нарушением её питания и уменьшением мышечного объёма;
- синдром Горнера — птоз (опущение верхнего века), миоз (сужение зрачка), энофтальм (западение глазного яблока).
Медиастинальная форма, при которой рак затрагивает средостение, развивается более агрессивно. Основные симптомы:
- трудности с дыханием — из-за сдавления трахеи;
- кровохарканье — при прорастании опухоли в дыхательные пути;
- осиплость голоса — из-за поражения опухолью возвратного нерва;
- боль — при прорастании опухоли в средостение и нервы [22].
Стадии плоскоклеточного рака лёгкого
Принципы стадирования одинаковые для всех видов рака лёгкого, в том числе для плоскоклеточного. Чтобы определить стадию, используется Международная классификация стадий злокачественных новообразований TNM, где T (tumor) означает размер опухоли, N (nodules) — поражение лимфоузлов, M (metastasis) — наличие отдалённых метастазов.
T — размер опухоли:
- Т1 — опухоль до 3 см в диаметре без признаков врастания в бронх. Может подразделяться на T1a, T1b и T1c в зависимости от размера новообразования.
- Т2 — опухоль от 3 до 5 см в диаметре или опухоль с врастанием в главный бронх, в висцеральную плевру (плёнку, окутывающую лёгкое) или с ателектазом (спадением). Может быть T2a или T2b.
- Т3 — опухоль от 5 до 7 см или с врастанием в другие структуры (в грудную стенку, диафрагмальный нерв, париетальный перикард), а также наличие метастазов в той же доле лёгкого.
- Т4 — опухоль более 7 см или есть поражение диафрагмы, средостения, сердца, крупных сосудов, трахеи, возвратного гортанного нерва, пищевода, тела позвонка, бифуркации (места разделения) трахеи или висцерального перикарда, а также метастазы в других (соседних) долях.
N — вовлечение регионарных лимфатических узлов:
- N0 — нет метастазов в регионарных лимфоузлах.
- N1 — метастазы в ближайших лимфоузлах со стороны расположения опухоли.
- N2 — метастазы в лимфоузлах средостения со стороны опухоли.
- N3 — метастазы в лимфоузлах противоположной стороны средостения или в надключичных лимфоузлах.
M — отдалённые метастазы:
- M0 — нет отдалённых метастазов.
- М1 — есть отдалённые метастазы:
- М1а — метастазы в противоположном лёгком либо опухолевое поражение плевры (оболочки лёгкого и грудной клетки изнутри), есть данные за метастатический плевральный или перикардиальный выпот, т. е. скопление жидкости в грудной полости, между листками плевры или в оболочках сердца.
- M1b — одиночный отдалённый метастаз, например в печени или головном мозге и т. д.
- М1с — множественные внелёгочные метастазы в одном или нескольких органах.
При наличии метастазов многие онкологи указывают поражённые органы специальными аббревиатурами:
- ADP — почки;
- BRA — головной мозг;
- HEP — печень;
- LYM — лимфатические узлы;
- MAR — костный мозг;
- OSS — кости;
- OTH — другие и т. д. [16].
Таблица 1. Стадии рака лёгкого по TNM
Осложнения плоскоклеточного рака лёгкого
Симптомы рака лёгкого зачастую проявляются очень поздно и связаны с быстрым развитием осложнений, поэтому некоторые состояния можно отнести и к симптомами, и к осложнениями. Выделяют локальные осложнения (в области лёгких) и отдалённые (при метастатическом поражении, например).
Локальные:
- Обтурация (закупорка) бронха с развитием рефлекторного кашля и воспаления ткани лёгкого, т. е. развитие обтурационной пневмонии.
- Кровохарканье.
- Лёгочные кровотечения — возникают при прорастании опухоли в сосуды.
- Нарушение дыхания (одышка, трудности при вдыхании воздуха полной грудью) — при сдавлении трахеи и главных бронхов большой опухолью или увеличенными внутригрудными лимфоузлами [1].
- Выраженный болевой синдром — при прорастании опухоли в грудную стенку (рёбра, плевру).
Отдалённые:
- Изменение голоса и/или хрипота — при поражении внутригрудных лимфоузлов и сдавлении возвратного нерва, отвечающего за движение и чувствительность голосовых связок.
- Нарушение притока крови к сердцу и оттока крови с периферии, чаще всего из верхней части туловища — при сдавлении верхней полой вены. При этом развивается синдром сдавления верхней полой вены — посинение верхней половины туловища, шеи и лица.
- Острая очаговая неврологическая симптоматика: нарушение движений в одной или нескольких конечностях, нарушение зрения, восприятия, резкая агрессивность, резкая выраженная слабость. Может развиваться, если появляются метастазы в головном мозге [1].
- Боли в костях с нарушением движений — при поражении костей [1].
- Печёночная недостаточность — при поражении печени метастазами, которые замещают большую часть её ткани.
Диагностика плоскоклеточного рака лёгкого
Самая главная диагностика рака лёгкого — скрининг, который подразумевает ежегодное прохождение лучевых методов исследований [12]. В России обычно выполняется флюорография, но в других развитых странах чаще всего прибегают к другим методам:
- рентгенографии — у людей вне зоны повышенного риска;
- низкодозной компьютерной томографии (КТ) — для всех из группы повышенного риска. К этой группе относятся курящие люди старше 40 лет, люди с хроническими заболеваниями лёгких, подверженные воздействию канцерогенов, работающие на вредных производствах и т. д. [13]
Это связано с тем, что у флюорографии низкая чувствительность: с её помощью нельзя выявить небольшие периферические новообразования без солидного (твёрдого) компонента или прикорневые новообразования (у центра лёгкого), которые могут «прятаться» от глаз рентгенологов.
Однако согласно рекомендации Минздрава по ежегодным профосмотрам и диспансеризации населения, даже если человек здоров, его ничего не беспокоит и он не входит в группу повышенного риска, ему всё равно стоит раз в год делать флюорографию.
При подозрении на онкологический процесс в лёгких и бронхах нужно обратиться к врачу-онкологу, который в ходе диагностики исключит или подтвердит заболевание. Стандартом диагностики рака лёгкого в России и мире является единый спектр исследований. Сначала проводится КТ грудной клетки с контрастированием. Оно позволяет обнаружить в лёгком новообразование, в том числе злокачественное [14].
Если такое образование выявляется, проводится дальнейшее дообследование:
1. КТ брюшной полости и малого таза с контрастированием. С его помощью можно исключить другие злокачественные новообразования и отдалённые метастазы. Или вместо него можно выполнить ПЭТ-КТ в режиме «всё тело» с 18-ФДГ. Это радионуклидный метод диагностики, он более современный, чем КТ.
2. КТ или МРТ головного мозга с контрастированием. Проводится, чтобы исключить метастазы в головном мозге. Их выполняют, даже если проводилось ПЭТ-КТ в режиме «всё тело», так как этот метод «не видит» головной мозг.
3. Трахеобронхоскопия с биопсией новообразования. В ходе этого исследования врач осматривает трахею и бронхи с помощью специального инструмента бронхоскопа, который вводится через рот или нос. Биопсия предполагает, что специалист отщипывает кусочек опухоли. Этот метод диагностики особенно важен при плоскоклеточном раке лёгкого, так как этот вариант рака чаще развивается в просвете бронха, а не снаружи его стенки.

Трахеобронхоскопия
Исследование нужно, чтобы получить гистологический материал (образец опухолевой ткани), определить морфологический подтип опухоли, провести иммуногистохимическое и молекулярно-генетическое исследования, которые необходимы для определения тактики системной противоопухолевой лекарственной терапии (при её необходимости). Могут быть варианты этого исследования: браш-биопсия и бронхоальвеолярный лаваж (БАЛ) — смывы воды из бронхов; чрезбронхиальная биопсия (ЧББ) — биопсия через стенку бронха насквозь и т. д. [23]
4. Эндобронхиальное или эндоэзофагеальное ультразвуковое исследование (EBUS или EUS). Это эндоскопический метод, который позволяет одномоментно оценить прилежащие структуры (опухоль, лимфатические узлы и др.) с помощью УЗИ. При необходимости во время исследования можно выполнить тонкоигольную аспирационную биопсию, например чтобы подтвердить или исключить поражение лимфатических узлов средостения, что очень важно, так как влияет на дальнейшую тактику лечения [23].
5. Гистологическое исследование с иммуногистохимическим исследованием. Это анализ кусочка опухоли, взятого во время биопсии, на онкомаркеры. В отличие от аденокарциномы, при плоскоклеточном раке лёгкого крайне редко встречаются активирующие мутации и транслокации (EGFR, ALK, BRAF, ROS1, RET, MET), на которые современная медицина научилась воздействовать и контролировать заболевание с помощью таргетной терапии. При плоскоклеточном раке лёгкого чаще всего определяется PD-L1. Это важный маркер, определяющий тактику лечения и возможность назначения иммунотерапии [24].
6. Гастроскопия. Позволяет исключить острые заболевания желудка, которые могут стать противопоказанием для начала лечения рака лёгкого. Проводится заранее, так как их выявление перед операцией или началом химиотерапии может отсрочить лечение. Если такие болезни обнаруживают, то сначала лечат их, а потом направляют свои силы на борьбу с раком.
Когда выбран метод лечения (в зависимости от стадии заболевания и гистологического заключения), потребуются дополнительные исследования:
- анализы крови;
- функциональные методы исследования: ЭхоКГ, ФВД (функция внешнего дыхания), УЗИ вен ног;
- анализы мочи и т. д.
Это нужно, чтобы определить, сможет ли организм перенести лечение.
Лечение плоскоклеточного рака лёгкого
Лечение чаще всего определяет онкологический консилиум, который состоит из онколога-хирурга, химиотерапевта и радиолога. Это позволяет выбрать лучший метод лечения, который даст пациенту самые высокие шансы на хороший результат.
При выборе лечения врачи всегда руководствуются клиническими рекомендациями Минздрава РФ, учитывая стадию заболевания и состояние организма человека (наличие выраженной сопутствующей патологии, острых заболеваний и т. д.) [15][16]. Однако единственным радикальным методом, который даёт шанс на излечение от онкологического диагноза, остаётся хирургическое лечение методом торакоскопии (через прокол в грудной клетке) или торакотомии (через вскрытую грудную клетку).
Наиболее предпочтительно применять малоинвазивные (малотравматичные) видеоторакоскопические технологии:
- VTS (ВТС) — видеоторакоскопию (она проводится с малыми разрезами — 1–1,5 см).
- или VATS (ВАТС) — видеоассистированную торакоскопию (с разрезом до 10 см).
Эти методы хирургии связаны с меньшим болевым синдромом и более быстрым восстановлением пациентов в раннем послеоперационном периоде.
При I стадии заболевания единственным радикальным методом лечения является хирургический — удаление одной доли или всего лёгкого (лобэктомия, пневмонэктомия).
Есть достаточно много информации, что при небольших периферических новообразованиях (менее 2 см), которые не проросли в висцеральную плевру и не дали метастазов в регионарные лимфоузлы, возможно провести сегментэктомию, т. е. удалить только один сегмент лёгкого. Доказано, что после сегментэктомии выживаемость и время без рецидива среди пациентов с I стадией рака лёгкого такая же, как и после лобэктомии [33]. Однако эта методика не входит в российские клинические рекомендации и может применяться только в ведущих центрах в исключительных случаях при наличии абсолютных показаний к этому варианту лечения. Таким показанием может быть, например, непереносимость пациентом «больших» вариантов оперативного лечения.

Типы операции при раке лёгкого
Если выполнить радикальную операцию невозможно или пациент отказывается от неё по разным причинам, может проводиться лучевая терапия в стереотаксическом режиме, который предполагает большие однократные дозировки лучевой нагрузки на область опухоли за короткий промежуток времени (по 10 Гр 5–6 раз). Этот метод рассматривается как самостоятельный вариант радикального лечения, однако по современным представлениям он проигрывает в дальней перспективе.
При II стадии лечение дополняют системной противоопухолевой лекарственной терапией, а именно химиотерапией. Она может проводиться до операции (если II стадия установлена в предоперационном периоде) или после (если стадию установили после планового гистологического исследования удалённого новообразования). Лучевая терапия может применяться как одновременно с химиотерапией (более предпочтительный вариант), так и раздельно.
При III стадии вариант лечения зависит от вовлечённости регионарных лимфатических узлов (N-статуса):
- При N2 — метастазах в лимфоузлах средостения со стороны опухоли. Операция ещё возможна в составе комплексного лечения (с химио- или химиолучевой терапией).
- При N3 — метастазах в лимфоузлах противоположной стороны средостения или в надключичных лимфоузлах. Операция не проводится, так как она не эффективна и не улучшает выживаемость пациентов. В таком случае рекомендуется проводить одновременную химиолучевую терапию в качестве самостоятельного варианта лечения.
При IV стадии основным методом лечения является системная противоопухолевая лекарственная терапия — химио-, иммуно- или таргетная терапия. Её проводит врач-химиотерапевт. Выбор препаратов, схемы и дозировок зависит от состояния пациента, распространённости опухолевого процесса, наличия мутаций, транслокаций, делеций, уровня PD-L1 и множества других факторов. Например, при наличии мутации в гене ALK пациенту предложат терапию Кризотинибом, в гене BRAF — Дабрафенибом и т. д. Хирургическое лечение таким пациентам не проводится, так как опухолевый процесс распространился по всему организму и его невозможно удалить.
В рамках клинических исследований и научных изысканий может применяться хирургическое лечение среди определённых групп пациентов. Например, есть данные, что пациентов с III–IV стадией, у которых была мутация в гене EGFR, прооперировали после того, как у них уменьшилось количество метастазов на фоне таргетной терапии, и операция оказалась эффективной [35]. Но этот вариант подходит далеко не всем пациентам, поэтому он не включён в клинические рекомендации Минздрава РФ, окончательное решение о тактике лечения пациента принимает только лечащий врач-онколог.
Паллиативное (симптоматическое) лечение направлено на продление жизни пациента и борьбу с основными симптомами, которые снижают качество его жизни, среди них боль, нарушение глотания пищи, температура, тошнота и т. д. Такое лечение не направлено на борьбу со злокачественным новообразованием, поскольку использование противоопухолевых препаратов не избавит от симптомов, мучающих пациента, и может привести к быстрой смерти. Сохранение качества жизни пациента, борьба с выраженными симптомами — очень важный этап, который позволяет пациенту не испытывать мучений и чувствовать себя лучше.
Осложнения лечения
У каждого из вариантов лечения могут быть свои осложнения:
- Хирургический метод: осложнения во время операции (кровотечения, нарушения ритма сердца) и после неё (воспаление ран, пневмония, тромбозы сосудов, нарушения ритма сердца, хилоторакс, пневмоторакс и т. д.). Такие осложнения возникают редко, но всё же нужно помнить, что они возможны.
- Лучевая терапия: дерматиты, пневмониты, эзофагиты, лимфадениты и т. д. Встречаются достаточно часто, но с ними можно справиться. Важно понимать, что польза лучевой терапии превышает риск их развития.
- Системная противоопухолевая лекарственная терапия (химио-, иммуно- и таргетная терапия). Каждый из вариантов лекарственной терапии имеет свои осложнения. Чаще всего развивается анемия, лейкопения (снижение уровня лейкоцитов), нейротоксичность (негативное влияние на нервную систему), кардиомиопатии (поражение сердца), токсическое поражение печени и почек и т. д.
Реабилитация пациентов
- После операции рекомендуется как можно раньше активизировать пациента, т. е. увеличить его двигательную активность. После выписки из стационара пациенту следует выполнять умеренные физические упражнения, дыхательную гимнастику, можно заниматься в группах лечебной физкультуры или в центрах реабилитационной медицины.
- После системной противоопухолевой лекарственной терапии рекомендации по реабилитации напрямую зависят от наличия и варианта осложнений. Если осложнения затронули кожу, показано лечение у дерматовенеролога, если желудочно-кишечный тракт — лечение и наблюдение у гастроэнтеролога, при возникновении полинейропатии — медицинская реабилитация у неврологов и реабилитологов и т. д. [16].
Прогноз. Профилактика
Прогноз при плоскоклеточном раке лёгкого зависит от стадии заболевания, общего состояния организма, наличия сопутствующих патологий, осложнений лечения и т. д. Есть данные по средней выживаемости пациентов, она представлена в таблице.
Таблица 2. Средняя выживаемость пациентов с диагнозом «рак лёгкого» [17]
Как и любая статистика, это усреднённые значения, которые невозможно применить в определении сроков жизни конкретного пациента. Предсказать прогноз конкретного пациента невозможно, даже зная точную стадию и определив тактику лечения. Он индивидуальный и зависит от сотен факторов, которые невозможно учесть, поэтому ко всем фразам: «Вам осталось … дней/месяцев» стоит относиться скептически. Определённо можно сказать только одно — прогноз без лечения хуже, чем у пациентов, получающих любой из вариантов лечения [28].
Профилактика плоскоклеточного рака лёгкого
Для профилактики рака лёгкого нужно избегать факторов, которые повышают риск оказаться в числе заболевших. Для этого важнее всего отказаться от вредных привычек, особенно от курения табака. Также рекомендуется:
- не работать во вредных и трудных производственных условиях;
- избегать контактов с производственными канцерогенами на опасных химических производствах и в местах, где используются их продукты производства (особенно с аэрозольными и дисперсными формами);
- избегать плохих экологических условий;
- проходить ежегодный скрининг и check-up организма после 40 лет.
Людям из группы повышенного риска рака лёгкого важно ежегодно делать низкодозную компьютерную томографию.
Список литературы
Sabbula B. R., Gasalberti D. P., Anjum F. Squamous Cell Lung Cancer // StatPearls Publishing. — 2024.ссылка
Comprehensive genomic characterization of squamous cell lung cancers // Nature. — 2012. — Vol. 489, № 7417. — Р. 519–525.ссылка
Gaillard F., Niknejad M., Sharma R. et al. Squamous cell carcinoma of the lung // Radiopaedia.org. — 2013.
Chandra S., Mohan A., Guleria R. et al. Delays during the diagnostic evaluation and treatment of lung cancer // Asian Pac J Cancer Prev. — 2009. — Vol. 10, № 3. — Р. 453–456.ссылка
Ruano-Raviña A., Provencio M., Calvo de Juan V. et al. Lung cancer symptoms at diagnosis: results of a nationwide registry study // ESMO open. — 2020. — Vol. 5, № 6.ссылка
Klein L. W. Pathophysiologic Mechanisms of Tobacco Smoke Producing Atherosclerosis // Curr Cardiol Rev. — 2022. — Vol. 18, № 6. ссылка
Stănescu D., Sanna A., Veriter C. et al. Airways obstruction, chronic expectoration, and rapid decline of FEV1 in smokers are associated with increased levels of sputum neutrophils // Thorax. — 1996. — Vol. 51, № 3. — Р. 267–271.ссылка
Croasdell Lucchini A., Gachanja N. N., Rossi A. G. et al. Epithelial Cells and Inflammation in Pulmonary Wound Repair // Cells. — 2021. — Vol. 10, № 2. — Р. 339.ссылка
Имянитов И. Е., Хансон К. П. Фундаментальная онкология: наиболее примечательные события 2004 года // Практическая онкология. — 2005. — Т. 6, № 1. — С. 1–5.
Jones A. Pathology of Cancer: Causes, Pathophysiology, Diagnosis, Prevention and Treatment // J Med Surg Pathol. — 2023. — Vol. 8, № 2. — Р. 1–2.
Gonzalez H., Hagerling C., Werb Z. Roles of the immune system in cancer: from tumor initiation to metastatic progression // Genes Dev. — 2018. — Vol. 32, № 19–20. — Р. 1267–1284. ссылка
PDQ Screening and Prevention Editorial Board. Lung Cancer Screening (PDQ®): Patient Version // National Cancer Institute. — 2002.
Hunger T., Wanka-Pail E., Brix G., Griebel J. Lung Cancer Screening with Low-Dose CT in Smokers: A Systematic Review and Meta-Analysis // Diagnostics (Basel, Switzerland). — 2021. — Vol. 11, № 6. — Р. 1040. ссылка
Нефёдов А. О., Костицын К. А., Гагуа К. Э. и др. Неинвазивные и инвазивные методы первичной и уточняющей диагностики рака лёгкого // Вопросы онкологии. — 2020. — Т. 66, № 1. — С. 42–49.
Лактионов К. К., Артамонова Е. В., Бредер В. В. и др. Практические рекомендации по лекарственному лечению немелкоклеточного рака лёгкого: практические рекомендации RUSSCO, часть 1 // Злокачественные опухоли. — 2023. — Том 13, № 3s2. — С. 42–65.
Ассоциация онкологов России. Российское общество клинической онкологии. Злокачественное новообразование бронхов и лёгкого: клинические рекомендации. — 2021.
Goldstraw P., Chansky K., Crowley J. et al. The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Lung Cancer // J Thorac Oncol. — 2016. — Vol. 11, № 1. — Р. 39–51.ссылка
Давыдов М. И., Аксель Е. М. Статистика злокачественных новообразований 2014 г. // Евразийский онкологический журнал. — 2016. — № 4. — С. 692–879.
Рекомендации по ранней диагностике рака лёгкого для врачей первичного звена // Вестник рентгенологии и радиологии. — 2016. — № 2. — С. 69–78.
Рак лёгкого / под ред. К. К. Лактионова и В. В. Бредера. — М.: ГРАНАТ, 2020. — 151 с.
Bi H., Ren D., Wu J. et al. Lung squamous cell carcinoma with rare epidermal growth factor receptor mutation G719X: a case report and literature review // Ann Transl Med. — 2021. — Vol. 9, № 24. — Р. 1805.ссылка
Полоцкий Б. Е., Тер-Ованесов М. Д. Рак лёгкого — некоторые аспекты клиники, диагностики и лечения // РМЖ. — 2005. — № 23. — С. 15–20.
Соколов В. В., Соколов Д. В., Пирогов С. С. и др. Современная бронхоскопическая диагностика раннего центрального рака лёгкого (обзор литературы) // Медицинский совет. — 2016. — № 15. — С. 62–66.
Мехеда Л. В. Иммуноцитохимический метод в дифференциальной диагностике первичных и метастатических новообразований внутригрудной локализации: автореф. дисс. ... канд. биол. наук: 14.01.12. — М., 2012. — 23 с.
Кононец П. В. Торакоскопические анатомические резекции лёгких при локализованном и местнораспространённом немелкоклеточном раке: автореф. дисс. ... д-ра мед. наук: 3.1.6., 3.1.9. — 2022. — 48 с.
Rusch V. Neoadjuvant atezolizumab in resectable non-small cell lung cancer (NSCLC): Initial results from a multicenter study (LCMC3) // J Clin Oncol. — 2018. — Vol. 36, № 15. — Р. 8541.
Antonia S. J., Villegas A., Daniel D. et al. Overall survival with durvalumab after chemoradiotherapy in stage III NSCLC // N Engl J Med. — 2018. — Vol. 379, № 24. — Р. 2342–2350. ссылка
Ganti A. K. P., Loo B. W., Bassetti M. Small Cell Lung Cancer, Version 2.2022, NCCN Clinical Practice Guidelines in Oncology // J Natl Compr Canc Netw. — 2021. — Vоl. 19, № 12. — Р. 1441–1464. ссылка
Юркова Ю. П., Мерабишвили В. М., Левченко Е. В. Эпидемиология и выживаемость больных раком лёгкого, влияние COVID-19 (клинико-популяционное исследование) // Вопросы онкологии. — 2022. — Т. 68, № 5. — С. 576–588.
Панкова О. В., Перельмутер В. М., Тузиков С. А., Денисов Е. В. Пре- и неопластические изменения бронхиального эпителия при плоскоклеточном раке и аденокарциноме лёгкого // Бюллетень сибирской медицины. — 2014. — Т. 13, № 3. — С. 100–110.
American Cancer Society. Key Statistics for Lung Cancer // Cancer.org. — 2024.
Bracken-Clarke D., Kapoor D., Baird A. M. et al. Vaping and lung cancer — A review of current data and recommendations // Lung Cancer. — 2021. — Vol. 153. — Р. 11–20. ссылка
Onaitis M. W., Furnary A. P., Kosinski A. S. et al. Equivalent Survival Between Lobectomy and Segmentectomy for Clinical Stage IA Lung Cancer // Ann Thorac Surg. — 2020. — Vol. 110, № 6. — Р. 1882–1891.ссылка
Lung transplant // Mayo Clinic. — 2024.
Chen Y.‐Y., Yen Y.‐T., Lai W.‐W. et al. Outcomes of salvage lung resections in advanced EGFR ‐mutant lung adenocarcinomas under EGFR TKIs // Thorac Cancer. — 2021. — Vol. 12, № 20. — Р. 2655–2665.ссылка

