Определение болезни. Причины заболевания
Дистрофии роговицы (Corneal dystrophy) — это группа наследственных заболеваний, при которых из-за нарушения белкового обмена в роговице накапливаются патологические вещества, что постепенно уменьшает её прозрачность и снижает остроту зрения.
![Помутнение роговицы при дистрофии [18] Помутнение роговицы при дистрофии [18]](/media/bolezny/distrofiya-rogovicy/pomutnenie-rogovicy-pri-distrofii-18_s.jpeg)
Помутнение роговицы при дистрофии [18]
Дистрофии роговицы нужно отличать от дегенераций: в отличие от дистрофий дегенерации не передаются по наследству, это спорадические (ненаследственные) болезни.
Что такое роговица
Роговица представляет собой переднюю прозрачную часть наружной фиброзной оболочки глаза. Она выполняет оптическую и формообразующую функцию. Упорядоченный коллагеновый матрикс придаёт ей механическую прочность.
В роговице нет сосудов и миелиновых оболочек вокруг нервов, что обеспечивает её прозрачность. Питание роговица получает из влаги передней камеры глаза, краевой петлистой сосудистой сети и кислорода воздуха. Полупрозрачная зона перехода роговицы в непрозрачную склеру называется лимбом [2][4].
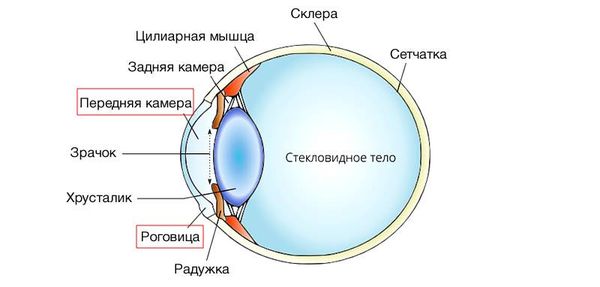
Строение глаза и расположение роговицы
Распространённость дистрофий роговицы
Нарушение прозрачности роговицы — одна из ведущих причин снижения зрения. Среди пациентов офтальмологических стационаров, которые лечатся в связи патологиями роговицы, на долю наследственных заболеваний приходится 7,7 %, из них 43,2 % составляют решётчатые дистрофии.
79 % вариантов дистрофий наследуются аутосомно-доминантно, это значит, что у последующих поколений риск унаследовать заболевание составляет 50 %. Инвалидность по зрению обычно не наступает, но если возникает, то обычно в молодом возрасте [10].
Дистрофия роговицы одинаково часто возникает и у мужчин, и у женщин, за исключением такой разновидности, как дистрофия роговицы Фукса — она чаще возникает у женщин [12].
Из-за бессимптомного течения трудно установить точный возраст начала развития болезни. Ребёнок изначально рождается с предрасположенностью к дистрофии (определёнными мутациями), но болезнь развивается постепенно и проявляется только спустя время или становится случайной находкой на осмотре. Поэтому детским офтальмологам следует обращать особое внимание на состояние роговицы при скрининговых осмотрах, которые проводится до года 4 раза, а потом каждый год.
Причины дистрофии роговицы
Дистрофии могут быть только первичными (врождёнными). Термин «вторичные (приобретённые) дистрофии», т. е. возникшие из-за каких-то болезней или внешних факторов, есть только в отечественной литературе, но на самом деле он неверный, так как дистрофия — это всегда наследственный процесс.
Причинами дистрофий роговицы являются генетические дефекты белков, отвечающих за структуру, транспорт или ферментативные реакции. Выработка таких аномальных белков ведёт к нарушению структуры и функции роговицы.
К факторам обострения дистрофий относят:
Симптомы дистрофии роговицы
Иногда изменения роговицы протекают без субъективных жалоб, и офтальмолог случайно обнаруживает эти изменения на осмотре. В остальных случаях могут возникнуть такие симптомы:
- Снижение зрения — может быть от незначительного до выраженного. Как правило, зрение снижается постепенно, в течение длительного времени.
- Нечёткость зрения, туман перед глазами, который не исправляется очками и не проходит после моргания или промывания глаз — может возникать при некоторых видах дистрофии.
- Светобоязнь и слезотечение разной степени выраженности, вплоть до того, что у человека снижается качество жизни и он не может работать.
- Боль — её спектр варьирует от слабого дискомфорта до сильной боли, возникает при наличии эрозий роговицы.
- Блефароспазм, т. е. сильное рефлекторное смыкание век [4][5].
В целом симптомы зависят от вида дистрофии. Но, как правило, они развиваются медленно и затрагивают оба глаза [12].
Патогенез дистрофии роговицы
В возникновении дистрофии роговицы повинны атипичные (патологические) белки, которые образуются из-за мутации генов. Наследование мутаций возможно по аутосомно-доминантному, аутосомно-рецессивному и х-сцепленному рецессивному типам, т. е. может зависеть от пола ребёнка и количества родителей, которые оказались носителями дефектного гена, например некоторые дистрофии могут передаваться только по материнской линии.
Выявлено 27 нозологических форм, т. е. видов дистрофий роговицы, включающих 49 генетических вариантов нарушения. Мутации могут затрагивать гены, которые отвечают за образование разных белков:
- тканеспецифических, участвующих в построении роговицы;
- транспортных;
- выполняющих функции ферментов;
- выполняющих транскрипционную функцию в процессе внутриутробного развития и закладки тканей.
Выработка атипичных белков ведёт к нарушению структуры и функции тканей, так как при их накоплении вся роговица или её участки теряют прозрачность, отекают, появляются участки эрозий эпителия [12].
Дистрофии протекают без признаков воспаления. Изменения локализуются на уровне эпителия, стромы, базальной мембраны (Боумена) или эндотелия [1][4][10].
Классификация и стадии развития дистрофии роговицы
Дистрофии роговицы представляют собой весьма разнородную группу двухсторонних наследуемых невоспалительных заболеваний, которые проявляются в разном возрасте и приводят к снижению прозрачности роговицы.
Их клиническая картина достаточно подробно изучена, но диагноз выставляется далеко не всегда правильно: например одно и то же заболевание разные врачи могут описывать под разными названиями или объединять под одним названием разные по механизму развития формы. Такие трудности с определением конкретной формы дистрофии роговицы связаны не только с объёмом знаний конкретного специалиста, но и с выраженным разнообразием клинических проявлений и генетической разнородностью [1][2][4].
За последние 20 лет произошёл прорыв в определении генов, ответственных за развитие многих типов дистрофий. Во многом это произошло благодаря Международному комитету по классификации дистрофий роговицы (IC3D), который был создан в 2005 году. Он объединил усилия нескольких групп исследователей, в результате были выявлены гены, участвующие в нормальном развитии роговицы. Также определены генетические мутации, вызывающие появление дистрофий роговицы, и типы их наследования.
Собранные данные по всем типам дистрофий в 2008 году были объединены в Классификацию дистрофий роговицы (IC3D Classification of Corneal Dystrophies), которая стала наиболее используемой. До недавнего времени самым актуальным было 2-е издание классификации, опубликованное в 2015 году, однако в апреле 2024 года вышло обновлённое 3-е издание [15][18].
В зависимости от того, какой слой роговицы поражён, классификация разделяет все дистрофии на 4 большие группы:
- Поверхностные дистрофии (их ещё называют передними, эпителиальными или субэпителиальными) — в патологический процесс первоначально вовлекается эпителий роговицы и базальная мембрана (Боумена).
- Эпителиально-стромальные дистрофии — одновременно поражается не только передний, но и средний слой (строма).
- Стромальные дистрофии — характеризуются поражением стромы роговицы.
- Эндотелиальные, или задние, дистрофии, — страдают внутренние слои, т. е. эндотелий и десцеметова мембрана [12][13].
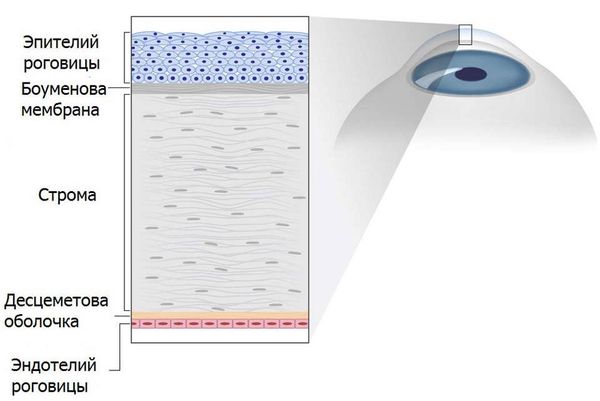
Строение роговицы
Поверхностные дистрофии
1. Дистрофия роговицы эпителиальной базальной мембраны (микрокистозная дистрофия Когана). Среди передних дистрофий роговицы она наиболее распространена. Согласно 3-му изданию классификации, в большинстве случаев наследование не подтверждено, поэтому считается, что патология развивается после травмы и является не дистрофией, а дегенерацией [18].
При этом состоянии образуется избыточная мембрана Боумена, которая выпячивается в эпителий, в итоге в нём появляются множественные базальные мембраны.
![Избыточная мембрана Боумена [18] Избыточная мембрана Боумена [18]](/media/bolezny/distrofiya-rogovicy/izbytochnaya-membrana-boumena-18_s.jpeg)
Избыточная мембрана Боумена [18]
Повреждённые клетки эпителия формируют микроцисты Когана, которые под микроскопом (при осмотре щелевой лампой) выглядят как помутнения в виде сероватых линий, отпечатков пальцев и точек.
У 10 % пациентов на третьем десятилетии жизни могут возникать рецидивирующие эрозии эпителия роговицы из-за отсутствия полудесмосом (фиксирующих белков) между клетками базального эпителия. У остальных заболевание может протекать бессимптомно в течение всей жизни, но возможно снижение зрения [4]. Оно успешно лечится с помощью фототерапевтической кератэктомии (ФТК), как в этом клиническом случае, и после этого можно добиться высокой остроты зрения с помощью склеральных линз.
2. Эпителиальные рецидивирующие эрозионные дистрофии (ЭРЭД). В 3-м издании классификации в этой группе выделено 4 дистрофии, но ответственный ген (COL17A1) определён только для одной из них, которая так и называется — ЭРЭД. Она наследуется по аутосомно-доминантному типу.
Все дистрофии этой группы проявляются болезненными эрозивными приступами, которые начинаются в первое десятилетие и могут беспокоить на протяжении всей жизни. Начинаются такие приступы обычно ночью, поэтому при пробуждении возникает острая односторонняя боль, покраснение, светобоязнь, помутнение зрения и слезотечение.
К 30–40 годам приступы эрозии роговицы становятся не такими тяжёлыми и частыми. К 40 годам примерно в 50 % случаев эрозии приводят к помутнениям в центральной части роговицы, которые медленно прогрессируют и снижают остроту зрения [15][18].
![Помутнение роговицы при эпителиальной рецидивирующей эрозионной дистрофии [18] Помутнение роговицы при эпителиальной рецидивирующей эрозионной дистрофии [18]](/media/bolezny/distrofiya-rogovicy/pomutnenie-rogovicy-pri-epitelialnoy-recidiviruyushyay-erozionnoy-distrofii-18_s.jpeg)
Помутнение роговицы при эпителиальной рецидивирующей эрозионной дистрофии [18]
3. Субэпителиальная муцинозная дистрофия роговицы. Наиболее вероятно аутосомно-доминантное наследование, но не исключён Х-сцепленный тип [15]. Ответственный ген пока неизвестен. Это очень редкая форма поверхностной дистрофии роговицы, при которой в первом десятилетии жизни возникают частые болезненные рецидивирующие эрозии роговицы. В подростковом возрасте эрозии возникают реже, но наблюдается прогрессирующая потеря зрения [17].
4. Дистрофия роговицы Меесмана (ювенильная эпителиальная дистрофия роговицы). Есть два генетических варианта заболевания с аутосомно-доминантным типом наследования: с мутациями в гене KRT3 на хромосоме 12q13 и гене KRT12 на хромосоме 17q12.
Чаще этот тип наследственной дистрофии роговицы начинает проявляться в первые 2–5 лет жизни ребёнка и характеризуется появлением классического роговичного синдрома: светобоязни, слезотечения, блефароспазма и перикорнеальной инъекции (покраснения вокруг роговицы).
Под микроскопом видны прозрачные эпителиальные кисты и утолщение мембраны Боумена. Изменения редко прогрессируют и не приводят к значимому снижению остроты зрения, поэтому лечение, как правило, не требуется.
5. Эпителиальная дистрофия роговицы Лиша. Во 2-м издании Классификации дистрофий роговицы отмечено, что это состояние имеет Х-сцепленный доминантный тип наследования, а ген на хромосоме Хр22.3 пока не идентифицирован [15]. Однако согласно 3-му изданию, дистрофию вызывает мутация гена MCOLN1, которая наследуется по аутосомно-доминантному типу [18].
Клинически (по проявлениям) похожа на дистрофию Меесмана. Начинает развиваться также в раннем детском возрасте. Эпителиальные кисты могут сливаться, образуя сероватые лёгкие помутнения, напоминающие решётку или завитки. Если процесс прогрессирует, появляются рецидивирующие эрозии, которые могут вызывать дискомфорт, боль, слезотечение и блефароспазм, а также вторичное инфицирование и воспаление роговицы. Учитывая снижение прозрачности роговицы, зрение будет медленно снижаться.
6. Желатинозная каплевидная дистрофия роговицы (студенистая каплевидная дистрофия, семейный субэпителиальный амилоидоз роговицы). Это редкое заболевание роговицы, которое наследуется аутосомно-рецессивным типом. Ответственный ген — TACSTD2. Начинает проявляться в первые 10 или 20 лет жизни жалобами на светобоязнь, слезотечение и снижение зрения.
Гистологически можно увидеть скопление амилоида (специфического белково-полисахаридного комплекса) под эпителием в передних слоях стромы. Клинически характеризуется появлением сливающихся серых узелков, которые увеличиваются и со временем становятся похожи на ягоду тутовника или шишку.
При значительном снижении зрения лечением является передняя послойная кератопластика (пересадка роговицы), однако после пересадки часто возникают рецидивы.
Эпителиально-стромальные дистрофии
1. Решётчатая дистрофия роговицы. Мутации в гене TGFB1 на хромосоме 5q31 передаются аутосомно-доминантным типом наследования. В 3-м издании классификации выделены два типа этой дистрофии: классическая решётчатая дистрофия роговицы и её варианты.
1) Классическая решётчатая дистрофия роговицы (решётчатая дистрофия роговицы 1-го типа, или дистрофия Бибера — Хааба — Диммера). Вызвана мутацией R124C. Это наиболее часто встречающийся тип решётчатой дистрофии. Под микроскопом видны точечные помутнения в передних отделах стромы.
При прогрессии заболевания они сливаются в тонкие ветвящиеся линии, в итоге проявляется картина решётки. Болезнь начинает развиваться в первые 10–20 лет жизни. К 40 годам из-за тотального помутнения роговицы обычно наблюдается выраженное снижение зрения.
2) Варианты решётчатой дистрофия роговицы. Вызваны мутациями, отличными от R124C. Могут проявляться в разном возрасте. В целом симптомы появляются позднее, чем при классическом варианте, зрение ухудшается, но гораздо медленнее.
![Картина решётки при одном из вариантов решётчатой дистрофии роговицы [18] Картина решётки при одном из вариантов решётчатой дистрофии роговицы [18]](/media/bolezny/distrofiya-rogovicy/kartina-reshyotki-pri-odnom-iz-variantov-reshyotchatoy-distrofii-rogovicy-18_s_EodPWqo.jpeg)
Картина решётки при одном из вариантов решётчатой дистрофии роговицы [18]
В 1-м издании классификации была выделена решётчатая дистрофия роговицы 2-го типа, но из следующих изданий она исключена, так как это не дистрофия роговицы как таковая, а глазное проявление семейного амилоидоза (синдрома Меретоя), при котором амилоид накапливается не только в роговице, но и в других органах и тканях.
Синдром Меретоя имеет аутосомно-доминантный тип наследования, вызван мутациями в гене GSN на хромосоме 9q34. Отложение амилоида на роговице проявляется появлением беспорядочно расположенных линий по краям, которые затем распространяются к центру. Линии толще и выражены чётче, чем при дистрофии. Острота зрения сохраняется достаточно высокой длительное время.
Помутнение роговицы сочетается с параличом лицевого нерва и рецидивирующими эрозиями. Системные сопутствующие изменения: двухстороннее поражение черепно-мозговых и спинномозговых нервов (например, при поражении тройничного нерва становится трудно жевать и снижается чувствительность лица), дизартрия (нарушение речи), тонкая сухая кожа, маскоподобное лицо с отвисающими губами и ушами. Сквозная или глубокая послойная кератопластика является радикальным методом лечения во взрослом возрасте, однако высок риск рецидива.
2. Гранулярные (зернистые) дистрофии роговицы:
1) Гранулярная дистрофия роговицы I типа. Её вызывает мутация в гене TGFB1 на хромосоме 5q31, наследуется дистрофия аутосомно-доминантным типом. Начинает развиваться в первые 10–20 лет жизни.
Под микроскопом на роговице в строме видны небольшие отдельно расположенные серовато-белые гранулы с чёткими границами — это отложения гиалина.
![Серовато-белые гранулы с чёткими границами (отложения гиалина) [15] Серовато-белые гранулы с чёткими границами (отложения гиалина) [15]](/media/bolezny/distrofiya-rogovicy/serovato-belye-granuly-s-chyotkimi-granicami-otlozheniya-gialina-15_s.jpeg)
Серовато-белые гранулы с чёткими границами (отложения гиалина) [15]
Прогрессия характеризуется увеличением количества очагов, их слиянием и распространением вглубь, периферия роговицы остаётся прозрачной. При этом типе дистрофии могут появляться рецидивирующие эрозии и светобоязнь. Острота зрения снижается с возрастом по мере того, как помутнений становится больше. Радикальным методом лечения является глубокая послойная или сквозная кератопластика или повторяющаяся ФТК при поверхностных изменениях.
2) Гранулярная дистрофия роговицы II типа (дистрофия Авеллино). Представляет собой сочетание гранулярной и решётчатой дистрофии. Выявлены мутации в гене TGFB1 на хромосоме 5q31, тип наследования — аутосомно-доминантный.
Под микроскопом наблюдаются разнообразные по форме и виду помутнения в передних слоях стромы: дисковидные, в виде колец или звёздчатые. Эти помутнения представляют собой отложения гиалина и амилоида.
![Помутнения при гранулярной дистрофии роговицы II типа [18] Помутнения при гранулярной дистрофии роговицы II типа [18]](/media/bolezny/distrofiya-rogovicy/pomutneniya-pri-granulyarnoy-distrofii-rogovicy-ii-tipa-18_s.jpeg)
Помутнения при гранулярной дистрофии роговицы II типа [18]
Проявляется в первые 10–20 лет жизни. Снижение зрения обычно медленно прогрессирует [15]. Лечение, как правило, симптоматическое при наличии эрозий.
3. Дистрофия роговицы Рейса — Бюклера (дистрофия боуменовой мембраны I типа). Наследуется по аутосомно-доминантному типу и связана с мутациями в гене TGFB1 на хромосоме 5q31. Проявляется уже в детском возрасте снижением зрения и повторяющимися эрозиями. Помутнение постепенно прогрессирует, мембрана Боумена уплотняется и превращается в рубец. ФТК или послойная кератопластика могут быть эффективны, однако возможны рецидивы.
4. Дистрофия роговицы Тиля — Бенке (дистрофия боуменовой мембраны II типа, или сотовая дистрофия) [13]. Передаётся аутосомно-доминантным типом наследования, вызывается мутацией в гене TGFBI. Проявляется повторяющимися эрозиями роговицы, которые начинаются в раннем возрасте (в 1–3 года), но бывают и сразу после рождения. Помутнения по виду напоминают соты.
Без лечения зрение снижается уже во 2–3-м десятилетии жизни. Патологический процесс иногда затрагивает поверхностные слои стромы.
Стромальные дистрофии
Стромальные дистрофии, как правило, приводят к снижению зрения. В эту группу входит 7 типов дистрофий.
1. Макулярная (или пятнистая) дистрофия роговицы. Тип наследования — аутосомно-рецессивный, мутация находится в гене CHST6 на хромосоме 16q22. Является наиболее редкой из группы стромальных дистрофий. Причиной её возникновения является отложение в строме гликозаминогликанов (ГАГ).
Клинически проявляется в первые 10 лет жизни снижением зрения и жалобами на засветы. Описаны случаи сочетания с истончением роговицы. На гистологии видно нарушение упаковки коллагеновых волокон в роговичные пластины и абнормальное склеивание ГАГ.
Радикальным методом лечения является сквозная кератопластика, но возможны рецидивы на трансплантате.
2. Дистрофия роговицы Шнайдера, или кристаллическая. Тип наследования — аутосомно-доминантный. Обнаружены мутации в гене UBIAD1 на хромосоме 1р36.3. Характеризуется отложениями холестерина в роговице. Начинает проявляться чаще в среднем возрасте (45–59 лет) снижением зрения в условиях сильной освещённости, диагностируется у пожилых.
Под микроскопом видно центральное облаковидное помутнение, состоящее из кристаллов холестерина, по краям — проминирующее (выступающее) липоидное кольцо. На роговице обнаруживается кристаллический сверкающий очаг под эпителием. Однако в половине случаев кристаллов не обнаруживается. Периферические отделы более прозрачны. На гистологии помутнения представляют собой депозиты холестерина. Лечением может быть ФТК.
![Помутнение роговицы при дистрофии Шнайдера [18] Помутнение роговицы при дистрофии Шнайдера [18]](/media/bolezny/distrofiya-rogovicy/pomutnenie-rogovicy-pri-distrofii-shnaydera-18_s.jpeg)
Помутнение роговицы при дистрофии Шнайдера [18]
3. Врождённая стромальная дистрофия роговицы. Это редкая патология роговицы — к 2009 году заболевание описано только в 4 семьях. Она связана с дефектом в гене DCN, который отвечает за образование белка декорина. Наследуется аутосомно-доминантно.
При осмотре можно обнаружить увеличение толщины роговицы за счёт того, что при этой патологии фибриллы коллагена стромы имеют меньший диаметр и упакованы более плотно. Под микроскопом можно увидеть многочисленные хлопьеобразные включения в виде перьев, которых с возрастом становится всё больше. Эта патология может осложняться вторичной глаукомой. Десцеметова мембрана и эндотелий не изменены. Эрозии роговицы, как правило, не возникают.
При значительном снижении зрения проводится сквозная или передняя послойная пересадка роговицы.
4. Дистрофия роговицы Флека, или крапчатая дистрофия Франсуа Нитенса. Наследуется по аутосомно-доминантному типу. Является редкой дистрофией с установленными мутациями в гене PIKFYVE.
При офтальмологическом осмотре можно увидеть мультиформные помутнения в виде снежинок и облачков в строме роговицы. Чаще всего такая дистрофия протекает бессимптомно, изменения не усугубляются.
5. Задняя аморфная дистрофия роговицы. Редкая дистрофия роговицы, её вызывают мутации генов KERA, LUM, DCN и EPYC. Имеет аутосомно-доминантный тип наследования. Впервые описана в 1977 году.
Характеризуется листовидным помутнением задней стромы роговицы, её истончением и уменьшением кривизны роговицы. Часто выявляется в первые 10 лет жизни и отмечается уже в возрасте 16 недель, что позволяет предположить врождённое происхождение. Острота зрения снижается незначительно [15].
6. Преддесцеметовая дистрофия роговицы. Во 2-м издании классификации отмечено, что это заболевание чётко не определено, но в 3-м издании выделен его новый подтип — точечная и полихроматическая преддесцеметовая дистрофия роговицы. Её вызывает мутация в гене PRDX3, передаётся патология аутосомно-доминантным типом наследования. Протекает бессимптомно, зрение обычно не нарушается [15][18].
7. Центральная облачная дистрофия Франсуа. Редкая форма дистрофии роговицы с неизвестным типом наследования. В 3-м издании классификации сообщается, что эта болезнь может быть дегенерацией.
В строме роговицы под микроскопом обнаруживаются маленькие мутные включения. Болезнь не прогрессирует, в большинстве случаев протекает бессимптомно, иногда отмечается лёгкая светобоязнь.
Дистрофии эндотелия и десцеметовой мембраны
1. Эндотелиальная дистрофия роговицы Фукса. Описана австрийским офтальмологом Фуксом в 1902 году. Это самый распространённый тип в этой группе, наследуется, как правило, по аутосомно-доминантному типу. Есть разные генетические варианты болезни с мутациями в генах COL8A2, TCF4, SLC4A11, ZEB1 и AGBL1. Встречаются и спорадические (ненаследственные) случаи. Чаще всего болезнь начинает развиваться в 4-м десятилетии или позже, но редкий ранний вариант начинается в первые 10–20 лет жизни.
Примерно у 4–4,5% пациентов после 50 лет есть дистрофия Фукса. Географическое распространение неравномерное: чаще встречается в Европе и США, реже — в Азии. Женщины болеют чаще мужчин (соотношение 3:1). Может сочетаться с первичной открытоугольной глаукомой [9].
Проявления дистрофии связаны со снижением плотности и физиологической активности эндотелиальных клеток, которые отводят избыток жидкости из роговицы и поддерживают её прозрачность. При дистрофии Фукса эндотелиальные клетки постепенно умирают или перестают работать должным образом, что приводит к скоплению жидкости (отёку) внутри роговицы. Это вызывает её утолщение и нечёткость зрения.
Когда одни эндотелиальные клетки погибают, площадь остальных увеличивается, клетки теряют правильную форму, истончаются, перекрывая образовавшиеся дефекты на месте погибших клеток. Изменяются не только клетки, но и десцеметова мембрана, которая представляет собой промежуточный слой между стромой и эндотелием роговицы. В норме у взрослого человека её толщина достигает 10–12 мкм, а при дистрофии Фукса толщина увеличивается в 2–4 раза и помимо 2 слоёв в норме можно увидеть 3 дополнительных за счёт того, что клетки эндотелия функционально начинают напоминать фибробласты и вырабатывают коллагеновые фибриллы [1][4][9].
В. В. Волков и М. М. Дронов в 1978 году предложили классификацию эндотелиально–эпителиальной дистрофии роговицы, которая также применима и к эндотелиальной дистрофии роговицы Фукса. Она включает 5 стадий:
- Эндотелиальная — характерны морфологические изменения клеток эндотелия, иногда возникает локальный отёк, возможно появление локальных складок десцеметовой мембраны.
- Стромальная — развивается стойкий отёк эндотелия и множественные складки десцеметовой мембраны.
- Эпителиальная (буллёзная) — возникает разлитой отёк эпителия, буллы.
- Сосудистая (неоваскулярная) — сосуды врастают в глубокие слои стромы.
- Терминальная (фиброзная) — прозрачная ткань замещается фиброзной и происходит стойкое помутнение роговицы, неравномерное по структуре, при этом плотные очаги фиброза сочетаются с менее плотными сосудистыми и буллёзными. Этот процесс сопровождается значительным снижением зрения вплоть до светопроекции, когда человек может лишь отличить свет от темноты и определить, где находится источник света [14].
Заболевание характеризуется появлением отёка стромы, больше выраженного по утрам, появлением эрозий, светобоязни, раздражением нервов внутри стромы, спазмом век из-за слезотечения и ощущения инородного тела.
Лечение на ранней стадии заключается в применении осмотических средств, чтобы вывести лишнюю жидкость. На стадии буллёзных изменений и рецидивирующих эрозий пациентам может помочь бандажная контактная линза [9].
Самый благоприятный прогноз будет при вовремя выполненной сквозной кератопластике. При сомнительном прогнозе по зрению подшивают конъюнктивальный лоскут [4].
2. Задняя полиморфная дистрофия роговицы. Это самый редкий вариант из группы эндотелиальных дистрофий. Согласно 3-му изданию классификации, её вызывают мутации в генах OVOL2, ZEB1 и GRHL2, которые наследуются аутосомно-доминантным типом. Протекает практически бессимптомно. При этой патологии клетки эндотелия по своим свойствам начинают напоминать эпителий, гистологически можно наблюдать на их поверхности ворсинки.
При осмотре под микроскопом видны многовариантные очаги помутнения в виде пузырьков, лент или географической карты, чаще они расположены асимметрично на обоих глазах. В ряде случаев этот тип дистрофии сочетается с недоразвитием структур угла передней камеры.
Лечение самой дистрофии, как правило, не требуется, так как эта форма протекает бессимптомно, однако может потребоваться симптоматическое лечение сопутствующих осложнений, например отёка роговицы [1][4].
3. Врождённая наследственная эндотелиальная дистрофия. Очень редкий вариант из группы «задних» дистрофий. Наследуется аутосомно-рецессивно, мутации выявлены в гене SLC4A11, проявляется после рождения и потом практически не прогрессирует [18]. По проявлениям схожа с дистрофией Фукса: тоже возникает диффузный отёк симметрично на обоих глазах, степень снижения остроты зрения соответствует степени помутнения роговицы — чем она мутнее, тем хуже зрение. У подростков, если не лечить, со временем возникает вторичная глаукома.
Дифференциальная диагностика проводится с врождённой глаукомой, родовой травмой, краснушным кератитом.
Зрение можно восстановить с помощью сквозной кератопластики в раннем возрасте, но высок риск рецидива.
4. Х-сцепленная эндотелиальная дистрофия роговицы. Наследование — Х-сцепленное доминантное. У женщин протекает бессимптомно, у мужчин часто наблюдается затуманивание зрения [15][18].
Осложнения дистрофии роговицы
Есть дистрофии, которые протекают бессимптомно, не приводят к осложнениям, не нуждаются в лечении и могут быть диагностированы случайно. К таким относятся дистрофия роговицы Флека, задняя аморфная дистрофия роговицы, центральная облачная дистрофия Франсуа и преддесцеметовая дистрофия роговицы. Однако некоторые виды (например, субэпителиальная муцинозная дистрофия роговицы) могут привести к стойкому и необратимому снижению зрения, что грозит снижением качества жизни, нетрудоспособностью и инвалидностью по зрению.
Некоторые виды эндотелиальных дистрофий без лечения осложняются вторичной глаукомой из-за вовлечения структур угла передней камеры глаза. В этом случае пациент может отметить ноющие боли в надбровье и глазном яблоке, тяжесть в глазу, затуманивание зрения из-за отёка роговицы, сужение полей зрения.
При нарушении функции эпителия из-за отёка возникают эрозии. Эрозивная поверхность открыта для патогенной флоры, поэтому эрозии могут осложниться присоединением инфекции и воспалением [12].
Диагностика дистрофии роговицы
Клиническая картина дистрофий роговицы очень разнообразна. Некоторые виды дистрофий могут протекать без жалоб, но при сильном помутнении роговицы пациенты могут заметить снижение зрения. Если вовлечён эпителий и появляются эрозии, беспокоит светобоязнь и слезотечение [1][2][5].
После выяснения жалоб врач будет собирать семейный и индивидуальный анамнез, т. е. спрашивать о заболеваниях глаз у самого пациента и его ближайших родных.
Информативными при диагностике являются инструментальные исследования:
- визометрия — измерение остроты зрения с коррекцией и без неё;
- кератометрия — измерение кривизны роговицы;
- кератотопография — определение кривизны передней и задней поверхности роговицы;
- пахиметрия — измерение толщины роговицы;
- биомикроскопия глаза — осмотр под микроскопом (щелевой лампой);
Биомикроскопия глаза
- эндотелиальная микроскопия — оценка количества эндотелиальных клеток на миллиметр квадратный, их размера и формы;
- оптическая когерентная томография (ОКТ) переднего отрезка глаза — оценка толщины и состояния всех слоёв роговицы.
Все из перечисленных методов обязательные.
Нарушения целостности эпителия роговицы, в том числе при рецидивирующих эрозиях, объективно можно оценить при окраске флюоресциином и осмотре в кобальтовом синем свете под микроскопом (т. е. при биомикроскопии).
При подозрении на генетическую причину врач может назначить генетическое исследование, чтобы выявить специфические мутации [1].
Дистрофию роговицы нужно отличать от заболеваний, которые сопровождаются воспалением, помутнением и эрозиями роговицы.
Лечение дистрофии роговицы
Тактика лечения зависит от вида дистрофии и выраженности её симптомов: в одних случаях может потребоваться только наблюдение, в других — консервативное лечение или операция [12]. Например, наблюдение может потребоваться как при незначительных изменениях роговицы, так и при выраженных, если пациента ничего не беспокоит. Даже при заметных нарушениях роговицы у него может быть отличная острота зрения [18].
Консервативное лечение
На ранних этапах возникновения дистрофии возможно применение симптоматического консервативного лечения, чтобы уменьшить тяжесть жалоб.
Оно может включать:
- Витаминные и антиоксидантные препараты.
- Лекарства, восстанавливающие эпителий: кератопротекторы, регенераторы и слёзозаместители без консервантов разной степени вязкости.
- Гормональные препараты. Их применяют, чтобы замедлить прогрессирование патологического процесса, так как гормоны уменьшают отёк, воспаление и рост сосудов. Их назначает врач строго по показаниям.
- Осмотические средства. Они помогают уменьшить отёчность роговицы.
При возникновении вторичных воспалительный изменений (например, конъюнктивита) применяют антибактериальные или антисептические средства и противовоспалительные препараты.
В некоторых случаях, например при рецидивирующих эрозиях, назначают лечебные контактные линзы, чтобы уменьшить дискомфорт и добиться заживления эрозий.
Хирургическое лечение
При помутнении передних слоёв роговицы на фоне эпителиальных и некоторых типов стромальных дистрофий может применяться фототерапевтическая кератэктомия — удаление поражённого участка роговицы с помощью эксимерного лазера.
При помутнениях, которые существенно снижают остроту зрения, как правило, применяются разные виды кератопластики (пересадки роговицы).
Кератопластика бывает:
- Сквозной — в этом случае пересаживают одномоментно все слои роговицы. Проводится при необратимом помутнения всех слоёв роговицы или выраженном отёке.
- Послойной — когда замены требует только часть ткани роговицы. Применяется, когда патологический процесс имеет локальный характер.
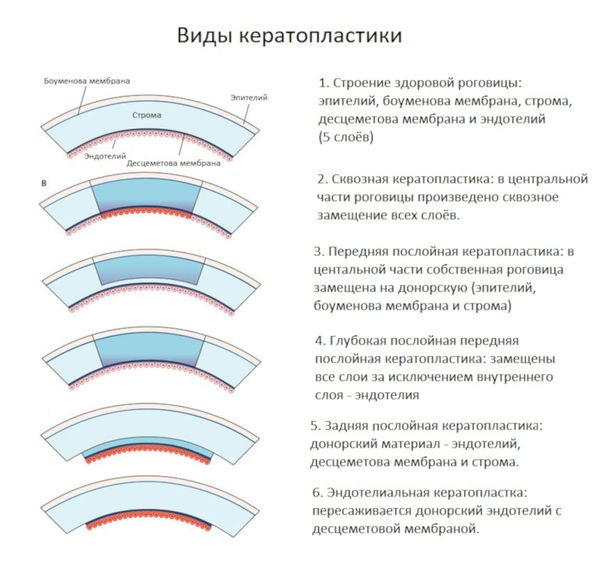
Виды кератопластики
Хирург всегда оценивает функциональную способность собственной ткани пациента и по возможности максимально её сохраняет.
Донорскую роговицу берут у недавно умерших людей, тщательно проверяют на наличие опасных инфекций, стандартизируют и консервируют. В России и других странах мира существуют специальные банки донорской роговицы, откуда глазные клиники при необходимости могут заказать материал. На совместимость тканей донора и реципиента не проверяют, поскольку роговица является бессосудистой тканью.
Увеличение продолжительности жизни ведёт к тому, что растёт количество пациентов, которым нужна пересадка роговицы. В то же время доноров со здоровой роговицей становится всё меньше. Из-за дефицита донорского материала была предложена методика частичной трансплантации лоскутами в 1/2 и 1/4 [3]. Это позволяет пересадить её не одному, а двум и более пациентам.
Например, в последние годы активно применяется пересадка десцеметовой мембраны с эндотелиальными клетками (DMEK), которая была предложена G. Melles в 2006 году. Эта операция проводится пациентам с патологическими изменениями задних отделов. Кроме более экономичного использования донорского материала, у неё есть и другие важные преимущества: более высокая острота зрения после лечения по сравнению с пересадкой десцеметовой мембраны с частью стромы (DSAEK) и более низкий риск отторжения трансплантата [3][11].
Однако технически процедура сложная и требует больше времени в освоении, кроме того, материал для трансплантации следует готовить предельно осторожно, максимально оберегая эндотелиальный слой.
В последние десятилетия при пересадке роговицы активно внедряется лазерная хирургия. Результат получается очень точным и прогнозируемым, поскольку лазерная установка работает по заданным параметрам на основании данных, полученных на диагностическом оборудовании.
Преимущества кератопластики с фемтосекундным лазерным сопровождением заключаются в более щадящем воздействии на ткани и более точном сопоставлении ложа донора и реципиента. Благодаря этому уменьшается степень послеоперационного астигматизма, выраженность отёка стромы и риск инфекционных осложнений, в целом сокращается период восстановления [8].
После операции острота зрения восстанавливается в течение 6–18 месяцев в зависимости от вида и объёма операции.
Подготовка и проведение кератопластики
Как и любая серьёзная офтальмологическая операция, кератопластика требует тщательной подготовки и взвешенного подхода. Если принято решение о проведении вмешательства, хирург подаёт заявку в банк донорского материала, а пациент проходит тщательное обследование, сдаёт все необходимые анализы.
Операция проходит под местным или общим обезболиванием в зависимости от возраста и состояния пациента. Веки фиксируют векорасширителем.
Если операция проводится при помощи фемтосекундного сопровождения, то лазер с высокой точностью удаляет изменённый участок, который подлежит замене, и выкраивает фрагмент для трансплантации из донорской роговицы. Лазерное излучение, имея высокую энергию и короткую длительность импульса, производит микроразрывы в ткани, отделяя слои друг от друга. Выкраивание лоскута вручную с помощью специального инструмента (трепана) всё ещё проводится во многих клиниках, но эта техника менее точна.
После перемещения фрагмента или всей роговицы хирург фиксирует его швами, этот этап операции требует высокой квалификации и опыта хирурга.
Послеоперационный период
Как правило, после операции пациент в течение 1–3 дней находится в стационаре под регулярным наблюдением офтальмолога, который следит за приживлением трансплантата, снимает швы после приживления материала, назначает симптоматическое лечение, если необходимо.
При некоторых соматических патологиях, например при сахарном диабете или артериальной гипертензии, а также в пожилом возрасте послеоперационный период проходит дольше и сложнее [4][5][7][8].
Чтобы реабилитационный период прошёл без осложнений, важно соблюдать все предписания доктора:
- пройти назначенное послеоперационное лечение;
- в течение месяца не купаться в бассейне и в открытых водоёмах, не посещать баню и избегать холодовых процедур;
- не тереть глаза в течение всего времени, которое установит хирург;
- на время исключить физические нагрузки;
- на время отказаться от вождения транспортных средств;
- раз в год наблюдаться у офтальмолога.
Осложнения кератопластики
В большинстве случаев кератопластика проходит успешно. Но есть небольшой риск отторжения трансплантата, при этом роговица мутнеет и зрение ухудшается. У пациента начинается светобоязнь, ощущается дискомфорт. Среди других осложнений, которые возможны после кератопластики:
- помутнение трансплантата (при этом может быть выполнена повторная кератопластика);
- инфекционные осложнения;
- отёк трансплантата;
- вторичная глаукома — может развиваться при блокировании путей оттока внутриглазной жидкости;
- геометрически неправильное приживление трансплантата и появление астигматизма [6][11].
Другие методы лечения
При некоторых дистрофиях пересадка центральной части роговицы даёт кратковременный эффект, так как возникает рецидив уже на трансплантате. В таких случаях методом лечения может быть пересадка лимбальных стволовых клеток, которые являются ростковой зоной и естественной границей между эпителием роговицы и конъюнктивы. Материал для трансплантации может быть взят со здорового глаза пациента или от умершего человека. Если материал берут от другого человека, необходима иммуносупрессивная терапия в послеоперационном периоде [6][11].
Если пересадить донорскую ткань невозможно, устанавливается искусственная роговица (кератопротез), которая крепится в толще собственной ткани.
Прогноз. Профилактика
Прогноз по зрению у большинства дистрофий благоприятный, наличие патологических изменений или вообще не снижает зрение, или снижает их незначительно, не приводя к инвалидизации по зрению.
Профилактика дистрофий роговицы
Профилактикой может быть планирование беременности, в частности своевременное генетическое обследование будущих родителей и тщательно собранный семейный анамнез перед беременностью [1][10]. Поэтому, если у родителей или близких кровных родственников были проблемы со зрением, перед зачатием рекомендуется проконсультироваться с офтальмологом.
Важную лепту в профилактику вносит и генетическое обследование плода. Его следует проводить в случае дистрофий, угрожающих потерей зрения.
Если выявлено единичный случай дистрофии в семье, то всем родственникам нужно пройти обследование у офтальмолога, даже если нет никаких жалоб.
За дополнение статьи благодарим Наталию Кривомазову — детского офтальмолога, автора и научного редактора портала «ПроБолезни».
Список литературы
Малюгин Б. Э., Антонова О. П. Клинико-генетические аспекты наследственных дистрофий роговицы // Офтальмохирургия. — 2015. — № 4. — С. 97.
Рожко Ю. И., Щемелёва О. А., Рожко А. А. Дистрофии роговицы: практическое пособие для врачей. — Гомель: ГУ «РНПЦ РМ и ЭЧ», 2020. — 88 с.
Оганесян О. Г., Макаров П. В., Грдиканян А. А. и др. Частичная трансплантация десцеметовой мембраны с эндотелием (½ и ¼ DMEK) // Российский медицинский журнал. — 2018. — Т. 24., № 2. — C. 78–82.
Кански Д. Клиническая офтальмология: систематизированный подход / пер. с англ. — М.: Логосфера, 2006. — 744 с.
Офтальмология. Национальное руководство. Краткое издание / под ред. С. Э. Аветисова, Е. А. Егорова, Л. К. Мошетовой, В. В. Нероева, Х. П. Тахчиди. — 2-е изд., перераб. и доп. — М.: ГЭОТАР-Медиа, 2014. — 740 с.
Михайлова В. И., Александрова К. А., Понятовская А. П. и др. Экспериментальная трансплантация лимбальных эпителиальных стволовых клеток на фибриновом скаффолде // Точка зрения. Восток — Запад. — 2019. — № 1. — С. 60–62.
Офтальмология. Фармакотерапия без ошибок: руководство для врачей / под ред. Ю. С. Астахова, В. П. Николаенко. — 2-е изд., перераб. и доп. — М.: Е-ното, 2021. — 800 с.
Костенев С. В., Черных В. В. Фемтосекундная лазерная хирургия: принципы и применение в офтальмологии. — Новосибирск: Наука, 2012. — 142 с.
Шилова Н. Ф. Cравнительный анализ результатов задней послойной кератопластики с использованием фемтосекундного лазера и микрокератома: автореф. дис. … канд. мед. наук: 14.01.07. — М., 2019. — 24 с.
Хлебникова О. В., Дадали Е. Л. Алгоритм дифференциальной диагностики моногенных заболеваний роговицы // Российская педиатрическая офтальмология. — 2013. — № 2. — С. 41–43.
Roat M. I. Corneal Transplantation // MSD Manuals. — 2022.
Boyd K. What Are Corneal Dystrophies? // American Academy of Ophthalmology. — 2023.
Moshirfar M., Bennett P., Ronquillo Y. Corneal Dystrophy // StatPearls Publishing. — 2024.ссылка
Дронов М. М. Глубокая дистрофия роговой оболочки и методы ее лечения: автореферат дис. ... канд. мед. наук: 14.00.08. — Л., 1978.
Weiss J. S., Mоller H. U., Aldave A. J. et al. IC3D Classification of Corneal Dystrophies — Edition 2 // Cornea. — 2015. — Vol. 34, № 2. — Р. 117–159.ссылка
Miller D. D., Hasan S. A., Simmons N. L., Stewart M. W. Recurrent corneal erosion: a comprehensive review // Clin Ophthalmol. — 2019. — Vol. 13. — Р. 325–335.ссылка
Subepithelial mucinous corneal dystrophy // Orphanet. — 2012.
Weiss J. S., Rapuano C. J., Seitz B. et al. IC3D Classification of Corneal Dystrophies — Edition 3 // Cornea. — 2024. — Vol. 43, № 4. — Р. 466–527.ссылка

