Определение болезни. Причины заболевания
Атриовентрикулярный канал (Atrioventricular canal) — это сложный врождённый порок сердца, при котором из-за неполного формирования перегородок и атриовентрикулярных (предсердно-желудочковых) клапанов возникает единое сообщение между предсердиями и желудочками сердца [1]. Проще говоря, внутри сердца образуется большой дефект (отверстие), соединяющий оба предсердия с обоими желудочками, а вместо двух раздельных клапанов (митрального и трёхстворчатого) функционирует один общий — атриовентрикулярный клапан (АВ-клапан).
Ещё одно название патологии — дефект предсердно-желудочковой перегородки.

Сердце в норме и при атриовентрикулярном канале
В целом врождённые пороки сердца встречаются примерно у 1 % новорождённых [2]. Из них на атриовентрикулярный канал (АВК) приходится около 3–5 % случаев [3]. Это примерно один случай на 3000–5000 новорождённых.
Причины атриовентрикулярного канала
Порок формируется из-за нарушения внутриутробного развития сердца. В норме перегородки между предсердиями и желудочками формируются при участии эндокардиальных «подушечек» — зачатков, из которых возникают перегородки и створки клапанов. Если эти структуры не срастаются полностью, перегородки остаются незавершёнными и предсердия сообщаются с желудочками через общий атриовентрикулярный канал.
Некоторые факторы могут повышать риск рождения ребёнка с таким пороком. Среди них:
- Генетические отклонения, в первую очередь синдром Дауна. Известно, что дефект атриовентрикулярной перегородки — один из наиболее распространённых пороков сердца у пациентов с этим синдромом [5].
- Другие хромосомные и генетические заболевания: синдром Вильямса, Ди Джорджи и др. [1]
- Семейная история пороков сердца.
- Недоношенность. Также может влиять морфофункциональная незрелость при рождении. Это состояние, при котором анатомические структуры сердца, особенно перегородки и клапаны, не только анатомически недоразвиты (морфологически), но и не выполняют свои функции в полной мере (функционально).
- Перинатальное инфицирование (внутриутробные инфекции) [1].
Во многих случаях порок возникает спорадически (случайно), т. е. без явных внешних причин.
Симптомы атриовентрикулярного канала
Проявления дефекта предсердно-желудочковой перегородки зависят от величины и формы дефекта: чем больше отверстие в перегородках, тем раньше и сильнее проявляются признаки болезни.
При полной форме АВК (большом дефекте) симптомы возникают уже в первые месяцы жизни. У грудных детей проявляется картина сердечной недостаточности: учащённое дыхание и одышка (особенно при кормлении), затруднённое сосание, плохая прибавка веса, чрезмерная потливость [6].
Нередко можно заметить бледность или лёгкий цианоз (посинение) губ и кожи при нагрузке. Также при обследовании сердца врач выслушивает характерные шумы, возникающие из-за большого дефекта и турбулентного потока крови через общий клапан.
Если дефект частичный (неполный), в раннем возрасте может не быть симптомов. Ребёнок с частичным АВК может нормально расти и развиваться в первые годы. По мере роста иногда отмечается отставание в физическом развитии и снижение выносливости. Начиная с подросткового или молодого возраста, появляются жалобы на быструю утомляемость, одышку при физической нагрузке, ощущение учащённого сердцебиения или перебои в работе сердца (аритмии) [6].
Однако если при частичном АВК сильно выражена клапанная недостаточность (обратный ток крови через створки), то признаки сердечной недостаточности могут появиться уже у грудного ребёнка, как при полной форме [1]. В некоторых случаях неполный дефект выявляется случайно при профилактическом осмотре по наличию характерного сердечного шума при аускультации (выслушивании).
Патогенез атриовентрикулярного канала
При АВК возникает шунтирование крови (патологический сброс) слева направо. Это означает, что часть уже насыщенной кислородом крови из левых отделов сердца возвращается через дефекты перегородок обратно в правые отделы и далее в лёгкие. Хотя в норме она должна идти в большой круг кровообращения и снабжать кислородом все органы и ткани. В результате перегружаются объёмом как правый желудочек, так и сосуды лёгких. Сердце вынуждено работать с повышенной нагрузкой, из-за этого развивается дилатация (расширение) полостей и возникают признаки сердечной недостаточности.
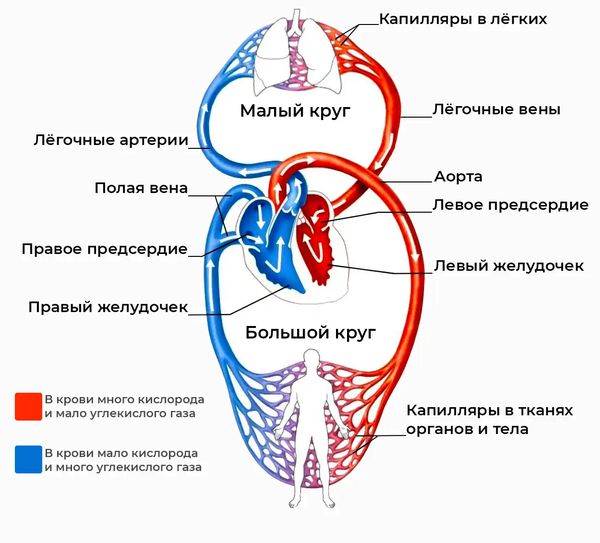
Круги кровообращения
Избыточный лёгочный кровоток ведёт к лёгочной гипертензии — повышению давления в лёгочных артериях. При полном дефекте (наличии большого отверстия на уровне как предсердий, так и желудочков) лёгочная гипертензия нарастает быстро: давление в малом круге может достигать системного (большого круга кровообращения) уже в течение первых 6–12 месяцев жизни ребёнка [1].
При повышенном лёгочном кровотоке и повышенном давлении (из-за сброса крови слева направо через дефект при АВК) сосуды испытывают хроническую перегрузку. Со временем в ответ на это сосуды перестраиваются:
- мышечный слой утолщается;
- интима (внутренний слой) разрастается;
- затем появляется фиброз (нормальная ткань заменяется рубцовой).
Эти изменения необратимы. Такое состояние называется вторичной облитерирующей лёгочной артериопатией.
При неполном АВК сброс крови происходит только на уровне предсердий, поэтому перегрузка малого круга выражена меньше и тяжёлая лёгочная гипертензия развивается медленнее (иногда не формируется вовсе).
Если давление в лёгочных артериях значительно возрастает, направление шунта может измениться на противоположное (т. е. кровь будет сбрасываться справа налево). Это приводит к попаданию венозной (необогащённой кислородом) крови в большой круг. Как следствие, уровень насыщения артериальной крови кислородом снижается и возникает центральный цианоз — синюшность губ, языка и слизистых оболочек. Такое состояние называется синдромом Эйзенменгера и означает, что хирургическая коррекция дефекта уже невозможна.
Классификация и стадии развития атриовентрикулярного канала
В зависимости от анатомических особенностей различают три формы АВК:
- Неполный (частичный). При этой форме дефект затрагивает преимущественно перегородку между предсердиями и сопровождается расщеплением передней створки левого АВ-клапана (т. е. митрального клапана), а межжелудочковая перегородка сохраняется без дефекта.
- Промежуточный. Характеризуется наличием:
- двух раздельных АВ-клапанов;
- расщепления передней створки митрального клапана;
- первичного дефекта межпредсердной перегородки (ДМПП), т. е. отверстия между предсердиями;
- обычно небольшого дефекта межжелудочковой перегородки (ДМЖП) в области под клапанами.
- Полный. При полной форме АВК между предсердиями и желудочками есть единый большой дефект (отверстие) и один общий АВ-клапан, разделяющий обе половины сердца [1].
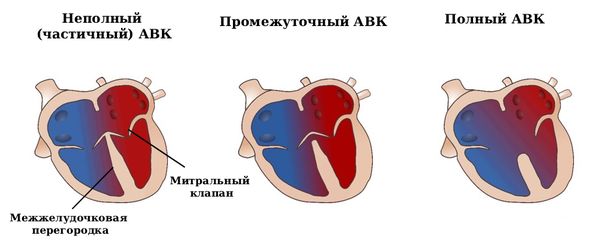
Формы АВК
Полная форма дефекта особенно характерна для детей с синдромом Дауна: по данным исследований, 58 % случаев АВК приходится на пациентов с этим заболеванием [8]. При полном АВК уже в младенческом возрасте развивается декомпенсация кровообращения — состояние, при котором сердце не может обеспечить адекватный кровоток для нужд организма. Это быстро приводит к тяжёлой сердечной недостаточности и лёгочной гипертензии. Без хирургической коррекции такой дефект прогрессирует до терминальной (последней) стадии в течение первых нескольких лет жизни.
У небольшой группы пациентов сердечная недостаточность может не развиться. Это касается пациентов с синдромом Дауна и полным АВК, при котором основной дефект приходится на уровень желудочков. Это связано с тем, что при синдроме Дауна сопротивление в лёгочных сосудах и так высокое с рождения из-за гипоплазии (недоразвития) лёгочных сосудов и других особенностей. Поэтому через большой дефект проходит меньше лишней крови в лёгкие, благодаря этому лёгкие не перегружаются и сердечная недостаточность может быть не так выражена.
При минимальном дефекте на уровне желудочков или незначительной клапанной регургитации (обратном токе крови) сердечная недостаточность встречается редко, однако без хирургической коррекции долгосрочная выживаемость крайне низкая — лишь около 25 % пациентов доживают до 40 лет [9].
В зависимости от степени развития желудочков АВК может быть сбалансированным либо несбалансированным:
- При сбалансированном варианте — оба желудочка развиты относительно пропорционально, и каждый из них получает адекватный приток крови через общий АВ-клапан. При таком дефекте возможна радикальная бивентрикулярная коррекция (восстановление нормального двухжелудочкового кровообращения хирургическим путём). Сбалансированность определяется по результатам эхокардиографии (ЭхоКГ).
- При несбалансированной форме АВК — один из желудочков значительно меньше другого. Это связано с тем, что общий АВ-клапан смещён преимущественно к одному (доминантному) желудочку, обеспечивая ему основной приток крови, тогда как другой желудочек получает мало крови, поэтому гипоплазирован (недоразвит). В таких ситуациях, как правило, невозможно провести полноценную двухжелудочковую коррекцию, поэтому выполняют паллиативную хирургическую коррекцию по принципу единственного желудочка. Несбалансированный вариант наблюдается приблизительно в 7–10 % случаев АВК. При этом примерно у двух третей таких пациентов доминирующим оказывается правый желудочек (с сопутствующей гипоплазией левого), а у оставшейся трети — левый (с гипоплазией правого) [1].
Классификация Rastelli выделяет три анатомических типа полной формы АВК в зависимости от особенностей строения передней (верхней) мостовидной створки общего АВ-клапана:
- Тип A (самый распространённый, встречается примерно в 69 % случаев) — хорды верхней мостовидной створки прикрепляются к гребню межжелудочковой перегородки, разделяя общий клапан на правый и левый компоненты.
- Тип B (наиболее редкий, составляет не более 9 % случаев) — хорды передней мостовидной створки прикрепляются не к перегородке, а к аномально расположенной добавочной сосочковой мышце, находящейся на правой стороне межжелудочковой перегородки ниже уровня её гребня. При этом разделение створки на митральную и трёхстворчатую части выражено неравномерно.
- Тип C (составляет около 22 % случаев) — мостовидная створка не прикреплена к перегородке: она остаётся цельной и свободно флотирует (двигается) над дефектом межжелудочковой перегородки, не фиксируясь хордами [1].
Осложнения атриовентрикулярного канала
Без своевременного хирургического лечения дефект предсердно-желудочковой перегородки неизбежно приводит к тяжёлой сердечно-сосудистой недостаточности. Развивается необратимая лёгочная гипертензия, переходящая в синдром Эйзенменгера, при котором венозная кровь попадает в артериальное русло и усиливается кислородное голодание органов. На этой стадии хирургическая коррекция уже невозможна.
Из-за перегрузки сердца у пациентов часто возникают нарушения сердечного ритма (мерцательная аритмия, желудочковые экстрасистолы и др.), вплоть до жизнеугрожающих, которые могут вызвать внезапную остановку сердца [8].
Диагностика атриовентрикулярного канала
Сбор анамнеза и осмотр
Предположить диагноз «атриовентрикулярный канал» врач-кардиолог может уже на основании клинических данных, которые он получит при сборе анамнеза (истории жизни и болезни) и физикальном обследовании: осмотре, аускультации (выслушивании) и др. К таким данным относятся:
- характерный шумовой феномен в сердце: у грудного ребёнка выслушиваются признаки усиленного кровотока в малом круге — громкий систолический шум над левым краем грудины, а также акцент II тона над лёгочной артерией;
- признаки перегрузки сердца и лёгких у ребёнка: одышка, учащённое дыхание, частые инфекции дыхательных путей и др.
Для подтверждения диагноза необходимы инструментальные исследования, так как сходные шумы и симптомы могут наблюдаться и при других пороках сердца (дефекте межжелудочковой перегородки, открытом артериальном протоке и др.).
Инструментальная диагностика
Электрокардиограмма (ЭКГ). На ЭКГ выявляются характерные изменения:
- Отклонение электрической оси сердца вправо.
- Признаки перегрузки правого желудочка: высокие зубцы R в правых грудных отведениях (особенно V1), глубокие зубцы S в левых отведениях (V5–V6), а также возможное появление rsR'-паттерна в V1. Дополнительно могут регистрироваться признаки перегрузки правого предсердия в виде остроконечного зубца P во II, III и aVF отведениях.
- Возможна неполная или полная блокада правой ножки пучка Гиса (нарушение прохождения импульсов по правой ветви пучка Гиса).
- Бывают признаки атриовентрикулярной блокады (нарушения проводимости электрического импульса от предсердий к желудочкам).
Рентгенография органов грудной клетки. Показывает кардиомегалию (увеличение сердца) за счёт расширения правых отделов сердца и усиление сосудистого рисунка в лёгких, что указывает на лёгочную гиперволемию (увеличение объёма крови в лёгочном круге). Рентгенография не обязательна при подозрении на АВК, но может быть полезна для оценки кардиомегалии и застойных изменений в малом круге кровообращения, особенно если есть признаки сердечной недостаточности.
Трансторакальная эхокардиография (УЗИ сердца) с цветным и импульсно-волновым допплеровским картированием. Это основной метод обнаружения дефекта. УЗИ сердца позволяет выявить анатомические особенности порока: размеры и место расположения дефектов, конфигурацию АВ-клапанов, степень регургитации, толщину стенок и размеры камер сердца, а также определить направление и объём шунта крови [6]. Эхокардиография — первый и наиболее доступный метод диагностики у новорождённых и грудных детей.
Чреспищеводная эхокардиография. Применяется в сложных клинических ситуациях, особенно у детей старшего возраста и взрослых пациентов.
Катетеризация сердца (зондирование полостей сердца) с измерением давления и насыщения кислородом в различных камерах. Выполняется, чтобы оценить сосудистое сопротивление в лёгочном круге и степень лёгочной гипертензии (в частности обратимость изменений в лёгочном русле). Это не обязательное исследование при АВК, но его могут проводить при планировании операции у пациентов с выраженными признаками лёгочной гипертензии или при поздней диагностике, так как при выявлении необратимых изменений в лёгочных сосудах операцию не проводят.
Дополнительные методы
Магнитно-резонансная томография (МРТ) сердца. Предоставляет трёхмерное изображение анатомии сердца и сосудов, а также позволяет без ионизирующего излучения оценить функцию миокарда, объём камер и точное расположение дефектов.
Компьютерная томография (КТ) с контрастированием. Используется, если нужно оценить анатомию лёгочных вен, аномальный венозный дренаж или сопутствующие пороки, особенно перед повторными вмешательствами.
Пренатальная диагностика
Возможна при проведении специализированного УЗИ на 18–22-й неделе беременности. УЗИ может выявить дефект перегородок, аномалию клапанов, кардиомегалию или признаки сопутствующих аномалий.
Если возникает подозрение на синдром Дауна или другую хромосомную патологию, врач может назначить неинвазивный пренатальный тест (НИПТ). Для его выполнения женщине нужно сдать кровь из вены. С помощью НИПТ можно оценить риск развития хромосомных патологий. Если по результатам теста риск высокий, для окончательного диагноза требуются амниоцентез или хорионбиопсия для кариотипирования плода (анализа числа и структуры хромосом):
- При амниоцентезе тонкой иглой прокалывают живот и матку и набирают околоплодные воды. В них содержатся клетки плода, которые затем исследуют.
- При хорионбиопсии тонкой иглой через живот (или иногда через шейку матки) получают образец ткани хориона (наружной зародышевой оболочки, окружающей эмбрион) и изучают его.

Амниоцентез
Диагностика у пациентов с синдромом Дауна
Новорождённым с синдромом Дауна, даже если у них нет симптомов, необходимо выполнить ЭхоКГ в ранние сроки жизни, поскольку у них высокая вероятность наличия врождённых пороков сердца (до 50 %). Помимо АВК, это может быть дефект межжелудочковой и межпредсердной перегородок (ДМЖП и ДМПП), открытый артериальный проток и тетрада Фалло. При этом АВК является самым часто встречающимся пороком у новорождённых с этим синдромом: на его долю приходится 40 % от всех случаев врождённых пороков сердца [5].
Лечение атриовентрикулярного канала
Радикальным методом лечения дефекта предсердно-желудочковой перегородки является хирургическая коррекция порока. Во время операции кардиохирурги закрывают отверстия в перегородках специальными заплатами и разделяют общий АВ-клапан на два раздельных клапана. Оптимальные сроки операции зависят от типа порока:
- При полном АВК рекомендуется выполнять коррекцию в возрасте около 3–6 месяцев, чтобы предотвратить развитие необратимой лёгочной гипертензии.
- Частичный АВК, если нет симптомов, оперируют позже — обычно в возрасте от 1 до 3 лет [6].
При развитии сердечной недостаточности до операции проводится медикаментозная терапия, направленная на облегчение симптомов. Назначаются мочегонные средства, препараты для усиления работы сердца и расширения сосудов [6]. Это помогает временно стабилизировать состояние пациента перед операцией.
Если радикальную коррекцию порока невозможно провести из-за крайне высокой лёгочной гипертензии, пациенту назначают только паллиативную медикаментозную терапию: кислород, препараты для снижения давления в малом круге, средства для поддержки сердца.
Наблюдение и возможные осложнения после операции
После операции пациенты должны находиться под наблюдением кардиолога. В течение первых 6 месяцев после коррекции порока перед любыми стоматологическими и хирургическими манипуляциями назначаются профилактические антибиотики, чтобы предотвратить инфекционный эндокардит. При наличии остаточных дефектов эту профилактику продолжают длительно [6].
Возможные осложнения после операции:
- Нарушения сердечного ритма. У молодых пациентов это осложнение встречается редко. Однако некоторым может понадобится имплантация кардиостимулятора из-за прогрессирования синдрома слабости синусового узла или спонтанной атриовентрикулярной блокады II степени [7][10].
- Прогрессирование клапанной недостаточности. Наиболее распространённой причиной повторной операции, которая требуется 5–10% пациентов, является усиление митральной регургитации. Риск повторных операций выше у пациентов, которые перенесли пластику в младенческом возрасте [4][3].
Прогноз. Профилактика
Прогноз при АВК напрямую зависит от своевременности и успеха хирургического лечения. Без операции полный АВ-канал приводит к гибели большинства пациентов уже в раннем детстве. В то же время развитие кардиохирургии значительно улучшило исходы: по данным исследований, у 80–95 % детей, перенёсших радикальную коррекцию АВК, не требуются повторные операции [8].
После успешно проведённой операции дети обычно нормально развиваются физически и интеллектуально. Смертность после пластики частичных и переходных дефектов атриовентрикулярной перегородки минимальна. Возможны остаточные эффекты, например умеренная клапанная недостаточность, нарушения ритма, но при необходимости их можно скорректировать медикаментозно или повторными вмешательствами. В целом качественно выполненная коррекция позволяет избавить пациента от симптомов и существенно продлить продолжительность жизни.
У людей с АВК риск рождения ребёнка с ВПС намного выше обычного: если у родителей без ВПС или с пороками, отличными от АВК, риск составляет 2–4 %, то у родителей с АВК — 14 %. Чаще всего у детей встречаются аналогичные формы порока или изолированные септальные дефекты, также у них часто встречается тетрада Фалло. Все остальные пороки сердца встречаются с обычной частотой, как у всех [1].
Профилактика атриовентрикулярного канала
Специфической профилактики этого врождённого порока нет, так как он формируется в первые недели развития эмбриона. Чтобы снизить риск рождения детей с АВК, женщине рекомендуется:
- планировать беременность;
- в первом триместре беременности по возможности исключить воздействие вредных факторов: инфекций (путём вакцинации и соблюдения мер предосторожности), алкоголя, наркотиков, некоторых лекарств, ионизирующей радиации;
- пройти медико-генетическое консультирование, если в семье были случаи врождённых пороков сердца;
- выполнять рекомендации врача по ведению беременности, при необходимости лечить сахарный диабет, токсикоз и др.;
- проходить пренатальные скрининги (УЗИ плода), которые помогают вовремя выявить тяжёлые пороки развития.
До и после хирургического лечения АВК всем пациентам необходима профилактика инфекционного эндокардита, которая включает своевременное лечение очагов инфекции и антибиотикопрофилактику перед хирургическими процедурами.
Список литературы
Ассоциация сердечно-сосудистых хирургов России. Ассоциация детских кардиологов России. Дефект предсердно-желудочковой перегородки (атриовентрикулярный канал): клинические рекомендации. — 2024. — 56 с.
Hoffman J. I., Kaplan S. The incidence of congenital heart disease // J Am Coll Cardiol. — 2002. — Vol. 39, № 12. — Р. 1890–1900.ссылка
Umapathi K. K., Agasthi P. Atrioventricular Canal Defects // StatPearls Publishing. — 2023. ссылка
Mery C. M., Zea-Vera R., Chacon-Portillo M. A. et al. Contemporary results after repair of partial and transitional atrioventricular septal defects // J Thorac Cardiovasc Surg. — 2019. — Vol. 157, № 3. — Р. 1117–1127.ссылка
Резник Е. В., Нгуен Т. Л., Ильина Т. С. и др. Синдром Дауна и сердечно-сосудистая патология: клиническое наблюдение и обзор литературы // РМЖ. — 2022. — № 9. — С. 35–40.
Beerman L. B. Defects of the Atrioventricular Septum (Endocardial Cushion Defects) // MSD Manual (Consumer Version). — 2023.
Ijsselhof R., Gauvreau K., Nido P. D., Nathan M. Atrioventricular Valve Function Predicts Reintervention in Complete Atrioventricular Septal Defect // World J Pediatr Congenit Heart Surg. — 2020. — Vol. 11, № 2. — Р. 247–248.ссылка
Calabrò R., Limongelli G. Complete atrioventricular canal // Orphanet J Rare Dis. — 2006. — Vol 1.ссылка
Craig B. Atrioventricular septal defect: from fetus to adult // Heart. — 2006. — Vol. 92, № 12. — Р. 1879–1885.ссылка
Houck C. A., Evertz R., Teuwen C. P. et al. Dysrhythmias in patients with a complete atrioventricular septal defect: From surgery to early adulthood // Congenit Heart Dis. — 2019. — Vol. 14, № 2. — Р. 280–287.ссылка

