Определение болезни. Причины заболевания
Амавроз Лебера (Leber's amaurosis) — это наследственное заболевание сетчатки, при котором дети полностью или частично теряют зрение в раннем возрасте или почти не видят с рождения. Для болезни характерна утрата центрального зрения, нистагм (повторяющееся неконтролируемое подёргивание глаз), вялая или отсутствующая реакция зрачка на свет и светобоязнь [2][3].
Синоним — врождённый амавроз Лебера (ВАЛ). В некоторых источниках болезнь называют генерализованным врождённым пигментным ретинитом [5].
Амавроз в переводе с греческого языка означает абсолютную слепоту (греч. Amauros — «тёмный, слепой»). Полная слепота может быть связана с многими причинами, в том числе и не офтальмологическими. Однако амавроз как самостоятельное заболевание впервые описал в 1869 году немецкий офтальмолог Теодор Карл Густав фон Лебер, в честь которого и назвали эту болезнь [1].
Распространённость
Амавроз Лебера относится к группе наследственных дистрофий сетчатки. Его мировая распространённость составляет 1 случай из 30–81 тыс. новорождённых, т. е. это довольно редкое заболевание [4]. При этом амавроз Лебера — одна из частых причин полной или частичной слепоты у детей до 10 лет [2]. Диагноз подтверждается более чем у 20 % детей, посещающих школы для слепых и слабовидящих. Среди всех наследственных дистрофий он отмечается более чем в 5 % случаев [4].
Причины амавроза Лебера
Причиной болезни являются мутации в генах, отвечающих за нормальную работу сетчатки — внутренней оболочки глаза, которая улавливает свет и помогает нам видеть.
Согласно одному из зарубежных источников, к 2021 году было определено уже 38 генов, участвующих в развитии заболевания, и исследования в этом направлении ещё продолжаются [4].
Гены в организме отвечают за образование белков. Мутации в генах приводят к тому, что белки формируются неправильно или совсем не образуются. При амаврозе Лебера нарушается формирование белков, которые помогают фоторецепторам сетчатки (палочкам и колбочкам) улавливать свет. Из-за разных видов этих нарушений сетчатка может изменяться по-разному, поэтому в каждом конкретном случае может быть различная степень снижения зрения, неоднородные изменения в сетчатке и неодинаковая остаточная функция поражённых фоторецепторов [4].
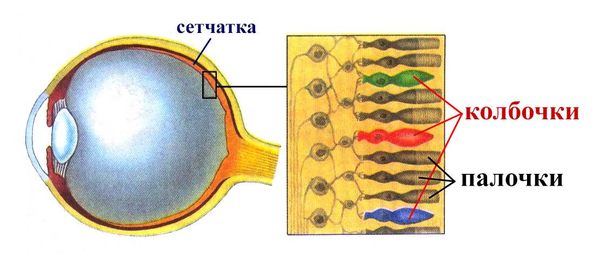
Палочки и колбочки сетчатки
Чаще отмечается аутосомно-рецессивный тип наследования, когда мутировавший ген передаётся от обоих родителей. Но встречается и аутосомно-доминантное наследование, при котором для развития болезни достаточно мутировавшего гена от одного родителя.
Фактор риска заболевания — это родитель, который болеет амаврозом Лебера или является носителем патологического гена, а также близкие кровные родственники, у которых была слепота с детства.
Симптомы амавроза Лебера
Основным симптомом болезни является отсутствие центрального зрения. При его утрате невозможно различить детали в центре поля зрения, вместо этого видно одно или несколько тёмных или размытых пятен. Бывают варианты, когда центральное зрение утрачено не полностью, в таких случаях отмечается концентрическое сужение зрения, при котором поля зрения выпадают со всех сторон, из-за чего зона видимости сильно сужается — сохраняется только в центре, как через трубу.
В большинстве случаев родители уже в первые 3–4 месяца жизни малыша сами могут заметить, что у ребёнка блуждающий взгляд, нистагм, он не фиксирует взгляд на предметах и не реагирует на яркий свет. Нередко появляется окулодигитальный симптом (симптом Франческетти) — ребёнок постоянно трёт и давит на глаза пальцем. В итоге из-за недоразвитой жировой клетчатки и постоянного давления глаз выглядит запавшим, что напоминает энофтальм.
Из-за частого трения глаза могут казаться воспалёнными. Также характерны светобоязнь, снижение зрения в сумеречное время («куриная слепота»), в редких случаях встречается кератоконус (заболевание роговицы, при котором она истончается и приобретает коническую форму) [6]. Как правило, ухудшение зрения прогрессирует, а в некоторых случаях сочетается с другими нарушениями:
- нефронофтизом — генетической болезнью почек;
- нарушением обоняния;
- умственной отсталостью;
- задержкой нервно-психического развития;
- неврологическими и нейромышечными нарушениями, например глазодвигательной апраксией, при которой сложно совершать волевые, целенаправленные движения глазами;
- церебральной атрофией (уменьшением объёма мозга из-за гибели нейронов) [5][7].
Амавроз Лебера может развиваться как у абсолютно здоровых детей, так и быть частью системного врождённого синдрома, поэтому при появлении описанных выше симптомов нужно как можно раньше обратиться к офтальмологу, чтобы он совместно с педиатром комплексно оценил здоровье ребёнка.
Патогенез амавроза Лебера
Сетчатка — это внутренняя оболочка глаза, которая обеспечивает зрительное восприятие. Свет, отражённый от предметов, попадает на сетчатку, где происходят сложные фотохимические реакции. Эти реакции преобразуют свет в нервный сигнал, который передаётся в головной мозг через зрительный нерв и зрительный тракт. Мозг понимает такие сигналы как картинку окружающего мира.
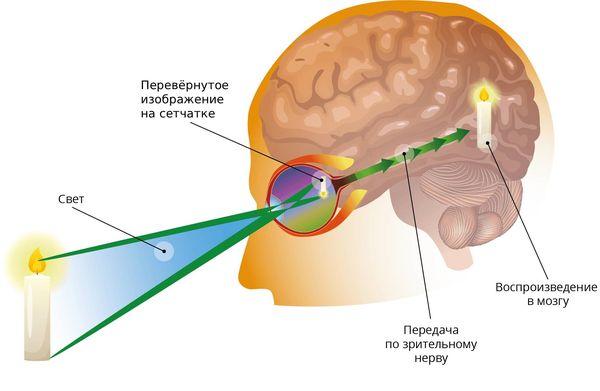
Как мы видим окружающий мир
Сетчатка обеспечивает центральное и периферическое зрение. Благодаря центральному зрению при прямом взоре мы видим чётко как близкие, так и дальние предметы. А периферическим зрением мы видим при непрямом взоре всё вокруг центрального объекта, благодаря чему можем ориентироваться в пространстве.
Все десять слоёв сетчатки участвуют в восприятии и передаче светового импульса, а за анализ цвета и формы в основном отвечают фоторецепторы: палочки и колбочки. В сетчатке около 100–120 млн палочек и около 7 млн колбочек. Палочки отвечают за восприятие формы объекта и света (день/ночь) за счёт преобразования пигмента родопсина. А колбочки — за цветовое восприятие за счёт пигмента йодопсина трёх цветов: красного, зелёного и синего. В ночное время преимущественно работают палочки, днём — колбочки, а в сумерках все фоторецепторы на определённом уровне активны.
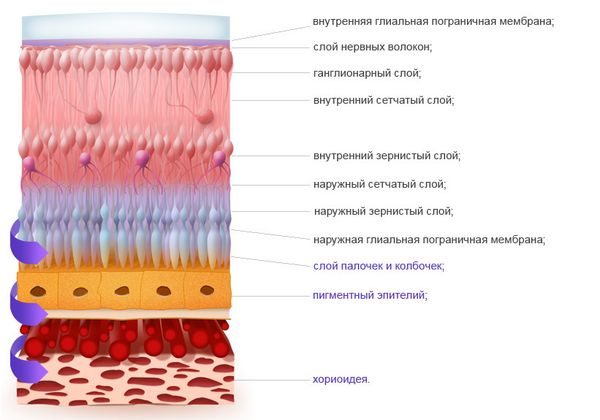
Слои сетчатки
В центре сетчатки (макуле) расположено больше колбочек, а за центральной частью — палочек. В сетчатке нет чувствительных нервных окончаний, поэтому патологические процессы чаще всего безболезненны.
При амаврозе Лебера из-за мутации генов нарушается эмбриональное развитие фоторецепторов, и они формируются неправильно: изменяется их структура, нарушается переработка и передача светового импульса. Поэтому зрение бывает сильно снижено уже с рождения. Но в зависимости от генетической формы степень снижения зрения и клинические проявления амавроза различны [8][9]. И даже может быть отсутствие заболевания у детей, родители которых страдают амаврозом, т. е. мутировавший ген им может не передаться.
Классификация и стадии развития амавроза Лебера
Амавроз Лебера относится к группе наследственных дистрофий сетчатки (НДС).
Классификация НДС:
- Дистрофии, при которых преобладают нарушения работы палочек:
- пигментный ретинит;
- палочково-колбочковая дистрофия;
- врождённый амавроз Лебера;
- дистрофия сетчатки с ранним началом;
- тяжёлая дистрофия сетчатки с началом в раннем детстве с врождённым или ранним ухудшением зрения.
- Дистрофии, при которых преобладают нарушения работы колбочек (включая наследственные макулярные дистрофии):
- колбочковые дистрофии;
- колбочково-палочковые дистрофии;
- макулярные дегенерации (болезнь Штаргардта, болезнь Беста и др.) [10].
Но при постановке диагноза врачи пользуются Международной классификацией болезней 10-го пересмотра (МКБ-10). Согласно ей, выделяют следующие наследственные дистрофии сетчатки:
- пигментный ретинит;
- болезнь Штаргардта;
- вителлиформные макулодистрофии (бестрофинопатии, в том числе болезнь Беста);
- врождённый амавроз Лебера;
- колбочковая дистрофия и колбочково-палочковая дистрофия [10].
Клинико-генетических форм амавроза Лебера довольно много, данные разнятся и продолжают обновляться. Например, в базе данных OMIM (онлайн-ресурс «Менделевское наследование у человека») отмечено 19 форм [26].
Клинико-генетические формы врождённого амавроза Лебера (ВАЛ), согласно OMIM
При разных формах могут быть разные проявления. Например при ВАЛ 2 наблюдается относительно хорошее зрение в раннем возрасте и возможно его временное незначительное улучшение, а при ВАЛ 7 — тяжёлая относительно стабильная потеря зрения уже в первые несколько месяцев жизни.
Осложнения амавроза Лебера
В зависимости от клинико-генетической формы ВАЛ дети могут не видеть с рождения, а могут постепенно терять зрение в течение первых 10 лет жизни. Зрение ухудшается медленно и стабильно, иногда бывает незначительное улучшение, но затем болезнь прогрессирует вплоть до частичной или полной слепоты.
Слепота влияет на развитие детей — они медленнее учатся говорить или двигаться, могут казаться замкнутыми, у них бывает снижен интеллект, но занятия с педагогами и врачами помогут им расти и учиться.
При некоторых формах будет нарушаться формирование глазных структур, например роговицы [7].
Если заболевание выявить на ранних этапах и определить патологический ген, то есть шанс провести генозаместительную терапию, сохранить и даже улучшить зрение, поэтому так важно как можно раньше обратиться к офтальмологу при появлении подозрительных симптомов [24].
Диагностика амавроза Лебера
Если родители заметили, что ребёнок боится света или не реагирует на него, не фиксирует взгляд или постоянно трёт глаза и давит на них, следует сразу обратиться к офтальмологу, который проведёт комплексное офтальмологическое обследование [7].
Диагноз наследственных дистрофий выставляется на основании жалоб, анамнеза (истории жизни и болезни), результатов офтальмологического и молекулярно-генетического обследования.
Сбор жалоб и анамнеза
При беседе с врачом важно рассказать о беременности и родах:
- были ли какие-то осложнения внутриутробного развития ребёнка или родовые травмы;
- на каком сроке родился ребёнок;
- каким был его вес и рост при рождении.
Также врач может спросить, как развивался ребёнок в течение первого года жизни, все ли навыки формировались в срок.
Офтальмологическое обследование
В него входит:
- Визометрия (проверка остроты зрения по таблицам) и авторефрактометрия (оценка рефракции глаза, т. е. его способности фокусировать световые лучи на сетчатке). Как правило, оценить остроту зрения по таблице невозможно из-за раннего возраста проявления болезни или слишком низкого зрения. Чаще всего зрение у таких детей соответствует счёту пальцев у лица, т. е. ребёнок может различить и посчитать пальцы на руке, если их поднести близко к лицу. Иногда определяется только светопроекция, при этом ребёнок может только различать наличие света и определять направление, откуда он исходит [14].
- Тонометрия (оценка внутриглазного давления). Внутриглазное давление при амаврозе Лебера, как правило, в пределах нормы. Его определяют для понимания индивидуальной нормы, чтобы своевременно выявить осложнения на фоне терапии.
- Биомикроскопия глаза (осмотр переднего отрезка глаза с помощью щелевой лампы). Её проводят, чтобы проверить прозрачность оптических сред (роговицы, хрусталика и стекловидного тела). В 46,4 % случаев при амаврозе обнаруживают врождённую катаракту (помутнение хрусталика) [15]. Иногда выявляется кератоконус.
Биомикроскопия глаза
- Офтальмоскопия в условиях медицинского мидриаза (осмотр глазного дна при расширенном зрачке). В начале заболевания типичных нарушений на глазном дне может и не быть, но позже появляются изменения в виде костных телец и атрофических фокусов [5]. Изменения на глазном дне оценивают не только при диагностике заболевания, но и в дальнейшем, чтобы следить за прогрессированием болезни: при плановом наблюдении офтальмоскопию нужно проходить 1 раз в 6 месяцев, а при мониторинге после введения лечебного препарата — через 1, 3, 6 и 12 месяцев и затем не реже 1 раза в год [11][16].
- Периметрия (оценка полей зрения). Тоже необходима как для диагностики заболевания, так и для оценки его прогрессирования. Если остаточное зрение позволяет провести это обследование, то, как правило, выявляют выраженное нарушение светочувствительности сетчатки и выпадение полей зрения вплоть до концентрического сужения [10].
- Биомикрофотография глазного дна с использованием фундус-камеры. Проводится при наличии необходимой аппаратуры. Фотографии глазного дна позволяют специалистам разного уровня отслеживать динамику объективно, а не только по субъективному офтальмоскопическому описанию. Поэтому исследование рекомендуется проводить всем пациентам с наследственной дистрофией сетчатки как при диагностике, так и при динамическом наблюдении и контроле за лечением [10].
- Проверка цветоощущения по таблице Рабкина или с помощью оттеночного теста Фарнсворта — Манселла. Это исследование можно провести только у детей с 6 лет и при наличии остаточного зрения. Оно может служить дополнительным методом для дифференциальной диагностики, так как при амаврозе наблюдается выраженное нарушение цветоощущения [10][17].
- Электроретинография (ЭРГ). С помощью ЭРГ оценивают электрофизиологическую активность сетчатки, возникающую в ответ на световое раздражение. По реакции на такое раздражение можно определить, насколько сохранена функция сетчатки. ЭРГ проводят в разных режимах: максимальном, общем, колбочково-палочковом, макулярном (локальном) или мультифокальном (мф-ЭРГ), если возможно, паттерн-ЭРГ [17]. Электроретинография является ключевым методом в установлении диагноза «амавроз Лебера», так как из-за раннего возраста пациентов и наличия нистагма не у всех возможно осмотреть глазное дно и оценить зрение. При амаврозе активность сетчатки не регистрируется или она сильно уменьшена, а вот нормальная ЭРГ полностью исключает этот диагноз [10][18].
- Оптическая когерентная томография (ОКТ) макулярной области. Это аппаратная диагностика состояния сетчатки, которая позволяет получить снимок с послойным её строением. При амаврозе часто наблюдается атрофия (истончение) сетчатки [2].
Если болезнь заподозрили у ребёнка до 3 лет, то в первую очередь проводится визометрия, авторефрактометрия, определение зрачкового рефлекса и ЭРГ, чтобы оценить зрительные функции ребёнка. При подозрении на амавроз Лебера в дошкольном и школьном возрасте важно провести комплексную диагностику.
Молекулярно-генетическое обследование
Чтобы окончательно подтвердить диагноз, необходима молекулярно-генетическая диагностика. При таком обследовании выделяют ДНК лейкоцитов из крови пациента и ищут патогенные мутации в генах, связанных с наследственными дистрофиями сетчатки. Для этого может применяться метод секвенирования нового поколения (NGS) и/или прямого секвенирования по Сэнгеру [9][10][11][12][13].
При подтверждении диагноза необходима консультация смежных специалистов (эндокринолога, невролога, сурдолога-оториноларинголога), чтобы исключить синдромные заболевания, которые могут сочетаться с амаврозом Лебера, такие как синдром Жубера, Сениора — Локена и др. [10][12] В некоторых случаях сначала ребёнка смотрят все врачи, а потом уже направляют к генетику, чтобы подтвердить диагноз.
Дифференциальная диагностика
Амавроз Лебера важно отличить от других заболеваний с похожими проявлениями: врождённых пигментных ретинитов, невротического амавроза, синдрома Жубера, врождённой стационарной куриной слепоты, болезни Сантавуори — Халтиа и др. [7]
Лечение амавроза Лебера
Основное лечение
Основным способом лечения генных мутаций является только изменение самих генов. И это возможно, хотя кажется фантастикой. С 20 апреля 2022 года в России проводится генозаместительная терапия с применением препарата Воретиген непарвовек (Лукстурна). Его назначают при амаврозе Лебера 2-го типа (ВАЛ 2), чтобы стабилизировать или улучшить зрение, если сохранилось достаточное количество жизнеспособных клеток сетчатки [19][21].
В 2021 году диагноз «наследственная дистрофия сетчатки, связанная с биаллельными мутациями в гене RPE65» (к таким дистрофиям относится и ВАЛ 2) и препарат Воретиген непарвовек включены в перечень медицинского обеспечения за счёт средств фонда «Круг добра». Этот фонд был создан для поддержки детей с жизнеугрожающими и хроническими заболеваниями, в том числе редкими.
Воретиген непарвовек вводится субретинально (под сетчатку). Процедура проводится в специализированных центрах в специально оборудованных операционных под общей анестезией.
После проведения генозаместительной терапии возможны осложнения, связанные с сетчаткой, хрусталиком, внутриглазным давлением и воспалительными процессами:
- хориоретинальная атрофия (истончение сетчатки и сосудистой оболочки) и эписклерит (воспаление наружной оболочки склеры) в зоне введения;
- макулярный (центральный) разрыв сетчатки;
- офтальмогипертензия (повышенное внутриглазное давление);
- катаракта;
- эндофтальмит (воспаление внутри глазного яблока).
Чтобы вовремя выявить и пролечить эти состояния, после введения препарата очень важно приходить на назначенные осмотры и обследования, в ходе которых врач будет оценивать состояние глаз, а также проверять остроту зрения. Контроль после введения препарата проводят через 1, 3, 6 и 12 месяцев и затем не реже 1 раза в год [20].
Но даже несмотря на возможные осложнения, такая терапия заметно улучшает зрение у пациентов и улучшает качество их жизни [24].
Для лечения других форм наследственной дистрофии сетчатки ведутся активные разработки генотерапевтических препаратов. Они находятся на разных этапах клинических исследований [9].
Поддерживающее лечение
В качестве поддерживающего лечения при наследственных дистрофиях сетчатки назначаются поливитамины в комбинации с минеральными веществами, содержащие лютеин и зеаксантин [10]. Эти зрительные пигменты защищают сетчатку от ультрафиолетового и синего спектра, от свободных радикалов и окислительного стресса, также они участвуют в обменных процессах и помогают поддерживать зрение.
При светобоязни могут назначаться очки со светофильтрами, предпочтение отдают очкам с защитой от синих световых лучей (L400) и фотохромным линзам. Если зрение полностью утрачено, улучшить качество жизни помогут специальные оптические приборы и электронные устройства [22].
Прогноз. Профилактика
Без генозаместительной терапии прогноз неблагоприятный: зрение обычно значительно ухудшается, вплоть до полной или почти полной слепоты.
При своевременно начатой терапии в некоторых случаях возможно сохранить и даже немного улучшить зрение. В специальных школах-интернатах детей могут научить адаптироваться к жизни, развивая слух, осязание и используя вспомогательные технологии, такие как шрифт Брайля или специальные устройства. Поддержка родителей, педагогов и общества играет ключевую роль в развитии и адаптации таких детей.
Профилактика амавроза Лебера
При планировании беременности, если в семье будущих родителей были случаи врождённых дистрофий сетчатки, паре рекомендуется пройти медико-генетическое консультирование, чтобы оценить риск рождения у них ребёнка с этим нарушением [23]. Других мер профилактики пока нет.
Чтобы выявить амавроз Лебера как можно раньше, важно всем детям с рождения и до 18 лет проходить плановые осмотры у офтальмолога в соответствии с календарём профилактических осмотров. Если диагноз подтверждается, офтальмологическое наблюдение при амаврозе Лебера проводится по индивидуальной схеме, но не реже чем 1 раз в 6–12 месяцев.
Список литературы
Leber T. Ueber Retinitis pigmentosa and angeborene Amaurose // Graefes Arch Clin Exp Ophthalmol. — 1869. — № 15. — Р. 1–25.
Kumaran N., Moore A. T., Weleber R. G., Michaelides M. Leber congenital amaurosis/early-onset severe retinal dystrophy: clinical features, molecular genetics and therapeutic interventions // Br J Ophthalmol. — 2017. — Vol. 101, № 9. — Р. 1147–1154.ссылка
Hamel C. P. Cone rod dystrophies // Orphanet journal of rare diseases. — 2007. — Vol. 2, № 7.ссылка
Huang C. H., Yang C. M., Yang C. H. et al. Leber's Congenital Amaurosis: Current Concepts of Genotype-Phenotype Correlations // Genes (Basel). — 2021. — Vol. 12, № 8. — Р. 1261.ссылка
Глазные болезни: учебник / под ред. проф. В. Г. Копаевой. — 5-е изд., испр. и доп. — М.: Офтальмология, 2024. — 482 с.
McMahon T. T., Kim L. S., Fishman G. A. et al. CRB1 Gene Mutations Are Associated with Keratoconus in Patients with Leber Congenital Amaurosis // Investigative Ophthalmology & Visual Science. — 2009. — Vol. 50, № 7. — P. 3185–3187.ссылка
Ely A. Leber Congenital Amaurosis // EyeWiki. — 2025.
Leroy B. P., Birch D. G., Duncan J. L. et al. Leber congenital amaurosis due to CEP290 mutations-severe vision impairment with a high unmet medical need: A Review // Retina. — 2021. — Vol. 41, № 5. — P. 898–907.ссылка
Кадышев В. В. Наследственные дистрофии сетчатки, вызванные биаллельными мутациями в гене RPE65. — М., 2021. — 36 с.
Ассоциация врачей-офтальмологов, Общество офтальмологов России, Ассоциация медицинских генетиков, Национальная ассоциация экспертов по санаторно-курортному лечению. Наследственные дистрофии сетчатки: клинические рекомендации. — 2024. — 46 с.
Coussa R. G., Koenekoop R. K., Traboulsi E. I. Leber Congenital Amaurosis // American Academy of Ophthalmology. — 2017.
American Academy of Ophthalmology. Guidelines on Clinical Assessment of Patients with Inherited Retinal Degenerations. — 2022.
Lam B. L., Leroy B. P., Black G. et al. Genetic testing and diagnosis of inherited retinal diseases // Orphanet J Rare Dis. — 2021. — Vol. 16, № 1. — Р. 514. ссылка
Кадышев В. В., Амелина С. С., Зинченко Р. А. Наследственная патология органа зрения в Ростовской области. В кн.: Методология генетико-эпидемиологического изучения наследственных болезней и врождённых пороков развития: учебно-методическое пособие / под ред. Зинченко Р. А., Амелиной С. С., Куцева С. И., Гинтера Е. К. — Белгород: ПОЛИТЕРРА, 2020. — С. 229–257.
Walia S., Fishman G. A., Jacobson S. G. et al. Visual acuity in patients with Leber's congenital amaurosis and early childhood-onset retinitis pigmentosa // Ophthalmology. — 2010. — Vol. 117, № 6. — P. 1190–1198.ссылка
Hong Y., Li H., Sun Y., Ji Y. A Review of Complicated Cataract in Retinitis Pigmentosa: Pathogenesis and Cataract Surgery // J Ophthalmol. — 2020.ссылка
Зольникова И. В. Современные электрофизиологические и психофизические методы диагностики при дистрофиях сетчатки (обзор литературы) // Офтальмохирургия и терапия. — 2004. — Т. 2. — С. 30–40.
Brecelj J., Stirn-Kranjc B. ERG and VEP follow-up study in children with Leber's congenital amaurosis // Eye (Lond). — 1999. — Vol. 13 (Pt. 1). — P. 47–54.ссылка
Russell S. et al. Efficacy and safety of voretigeneneparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: a randomised, controlled, openlabel, phase 3 trial // Lancet. — 2017. — Vol. 390. — P. 849–860.ссылка
Кадышев В. В., Зольникова И. В., Халанская О. В., Степанова А. А., Куцев С. И. Наследственная дистрофия сетчатки: первые результаты после RPE65-генозаместительной терапии в России // Вестник офтальмологии. — 2022. — Т. 138, № 4. — С. 48–57.
FDA approves hereditary blindness gene therapy // Nat Biotechnol. — 2018. — Vol. 36, № 1.ссылка
Otsuka Y., Oishi A., Miyata M. et al. Wavelength of light and photophobia in inherited retinal dystrophy // Sci Rep. — 2020. — Vol. 10, № 1. ссылка
Малюгин Б. Э., Борзенок С. А., Хлебникова О. В. и др. Актуальность медико-генетического консультирования при различных формах абиотрофии сетчатки // Офтальмохирургия. — 2016. — № 2. — С. 42–46.
Kiraly P., Cottriall C. L., Taylor L. J. et al. Outcomes and Adverse Effects of Voretigene Neparvovec Treatment for Biallelic RPE65-Mediated Inherited Retinal Dystrophies in a Cohort of Patients from a Single Center // Biomolecules. — 2023. — Vol. 13, № 10. — Р. 1484.ссылка
Gokuladhas K., Sivapriya N., Barath M., NewComer C. H. Ocular Progenitor Cells and Current Applications in Regenerative medicines — Review // Genes & Diseases. — 2017. — Vol. 4, № 2. — P. 88–99.ссылка
O'Neill M. J. F. Leber congenital amaurosis 1; LCA1 // OMIM. — 2024.

