Определение болезни. Причины заболевания
Снижение овариального резерва (СОР) — это уменьшение либо отсутствие реакции яичников на стимулирующую терапию. Заболевание "Снижение овариального резерва" в МКБ-10 (Международной Классификации Болезней 10-й редакции) отсутствует [1]. Наиболее близкие термины:
- E28.3 — Первичная яичниковая недостаточность;
- E28.8 — Другие виды дисфункции яичников.
Термин "Снижение овариального резерва" появился благодаря успехам в области репродуктивной медицины, где основной задачей стимулирующей терапии является получение не одной, а нескольких яйцеклеток. Большинство отечественных авторов рассматривают овариальный резерв как функциональную возможность яичника формировать фолликулы со зрелым (полноценным) ооцитом [4][5][6].
Распространение вспомогательных репродуктивных технологий привело к тому, что овариальный резерв и его снижение рассматриваются с позиций ответа яичника на воздействие гонадотропных препаратов. Гонадотропины — группа препаратов, оказывающих влияние на половые железы, в том числе способствующие созреванию фолликулов в яичниках. Нормальный овариальный резерв — адекватному ответ яичников на стимуляцию. Под адекватным ответом понимается требуемый рост фолликулов и получение достаточного количества ооцитов. Достаточное количество определяется не столько числом получаемых ооцитов, сколько количеством полученных после оплодотворения эмбрионов с правильным хромосомным набором.
В зависимости от возраста женщины для получения одного нормального эмбриона требуется разное количество ооцитов:
- до 39 лет — от 3 до 5 ооцитов;
- в 40 лет – не менее 7;
- в 41 год — 9 и более;
- в 42 года — более 12;
- в 45 лет — не менее 44 [50].
Сниженный овариальный резерв при стимуляции для женщины до 39 лет — это менее 5 ооцитов [37].
Предложенная терминология описывает только функциональный резерв, но не учитывает пула покоящихся (примордиальных) фолликулов. Примордиальные фолликулы — это мелкие фолликулы, которые формируются к моменту рождения и располагаются в виде скоплений под белочной оболочкой яичника. Именно поэтому исследователи предлагают использовать термин "овуляторный потенциал", то есть способность фолликула к овуляции при адекватной стимуляции гонадотропинами [7]. Также предлагаются альтернативные определения, такие как "потенциал рождаемости", "репродуктивный резерв", но с обязательным включением в определение пула покоящихся фолликулов. С практической точки зрения, такие определения спорны, так как объективно измерить пул покоящихся фолликулов без гистологического исследования невозможно.
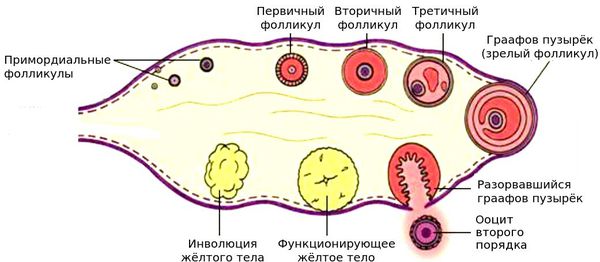
Развитие фолликула в яичнике
Причины развития СОР можно условно разделить на две группы:
- Физиологические. Возраст — ключевой физиологический фактор, определяющий постепенное снижение овариального резерва [8]. С увеличением репродуктивного возраста снижается количество и качество ооцитов. Кроме того, в отличие от других клеток организма, половые клетки не регенерируют [8][9]. У 95 % женщин в возрасте 30 лет присутствует только 12 % ооцитов от их количества до рождения, а к 40 годам — только 3 % [10].
- Патологические. К ним относятся заболевания, ятрогенные причины (осложнения после лечения), влияние факторов внешней среды. Сюда входят и генетически обусловленные нарушения:
- анеуплоидия (присутствие дополнительной или отсутствие одной хромосомы) и структурные перестройки Х-хромосомы;
- cиндром Шерешевского — Тернера и другие заболевания, связанных с нарушениями эмбрионального развития половых желёз;
- cиндром ломкой Х-хромосомы — мутация в гене FMR1 в Х-хромосоме;
- наличие аутосомных генетических мутаций (галактоземия);
- аутоиммунные болезни — наличие антител к клеткам, которые синтезируют половые гормоны (болезнь Аддисона) и аутоиммунные заболевания щитовидной железы.
Симптомы снижения овариального резерва
Снижение овариального резерва — процесс, растянутый во времени, которые чаще всего протекает без симптомов. Причиной, заставляющей женщину обратиться к врачу, является отсутствие беременности (бесплодие).
Наиболее яркие симптомы, которые характеризуют угасание функции яичников, — признаки эстрогенной недостаточности (приливы, потливость, тахикардия) и со временем аменорея в возрасте до 40 лет [17][18].
Патогенез снижения овариального резерва
Снижение общего количества ооцитов происходит в течение всей жизни женщины. Пиковое количество ооцитов, присутствующих в яичнике, определяется ещё до рождения: на 20-й неделе внутриутробного развития в яичниках плода женского пола закладывается порядка 7 млн оогониев (предшественников ооцитов) [12][13], но уже с 24-26 недели внутриутробного развития их количество снижается. Это происходит в результате процесса, известного как атрезия [11]. Атретический фолликул — фолликул, подвергающийся обратному развитию, в нём имеются признаки гибели ооцита (сморщенная блестящая оболочка, уменьшенный объём цитоплазмы и сморщивание клеточного ядра).
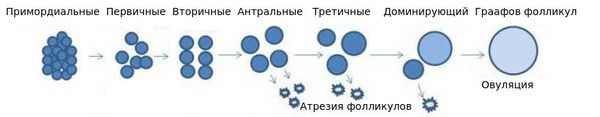
Фолликулогенез
К началу полового созревания количество ооцитов не превышает 300 тысяч [12][13]. В течение всей жизни овуляции достигают не более 400-500 фолликулов [14][15].
Наиболее быстрыми темпами снижение овариального резерва происходит при достижении женщиной 37-38 лет. В этот период скорость потери фолликулов увеличивается практически вдвое [16].
Механизмы потери фолликулов с возрастом недостаточно изучены, но проведённые исследования показали, что при сокращении примордиального пула фолликулов до 25000 скорость потерь удваивается. Обычно такое сокращение происходит к 37,5 годам [51].
К другим причинам, оказывающим негативное влияние на уровень овариального резерва, относятся:
- Воспалительные заболевания органов малого таза. Результатом воспаления яичников является выраженный склероз стромы (соединительной ткани, покрывающей яичник) с сопровождающим его нарушением питания фолликулярного аппарата и снижением пула примордиальных фолликулов [20][21].
- Ятрогенные причины. На сегодняшний день известно, что любое оперативное вмешательство на яичниках приводит к значительному снижению овариального резерва и как следствие к уменьшению эффективности методов вспомогательной репродукции [24]. Одним из наиболее частых вмешательств при лечении синдрома поликистозных яичников до недавнего времени была операция по иссечению не менее 2/3 ткани яичника. Ещё более травматичной и необоснованной хирургической тактикой является оперативное лечение ретенционных кист яичников — доброкачественного образования, возникшего вследствие закрытия протока наботовой железы. Последствием подобной оперативной тактики становится потеря значительной части функциональной ткани яичника [22]. Сегодня подобные вмешательства встречаются достаточно редко, но это не единственный пример "хирургического экстремизма". В анамнезе многих женщин, обращающихся за помощью по поводу бесплодия, есть указания на перенесённые операции на органах малого таза [22][23]. Проведённые вмешательства (аппендэктомия, удаление ретенционных кист яичников, восстановление проходимости маточных труб, коагуляция очагов эндометриоза) часто приводят к возникновению спаечного процесса в малом тазу [22][23]. Спаечный процесс вызывает выраженные сосудистые изменения, нарушение трофики яичника и негативно воздействует на уровень овариального резерва [25][26].
- Алкогольная и никотиновая интоксикации[19]. Существенную негативную роль на уровень овариального резерва оказывает табакокурение. Показано, что токсическое действие никотина на яичники проявляется в ускорении процессов апоптоза (гибели) фолликулов, что проявляется снижением концентрации уровня АМГ (антимюллерового гормона) [27][28]. Аналогичным действием обладает и употребление алкоголя [29].
- Лучевая и химиотерапия. Крайне негативно на овариальный резерв и репродуктивную функцию влияет радиационное облучение и химиотерапия при лечении онкологических заболеваний. Следствием этих воздействий часто становиться почти полная потеря овариального запаса яичников, преждевременное угасание их функции и ранняя менопауза [31]. Решающими факторами при проведении химио- или лучевой терапии является доза радиации, а также репродуктивный возраст женщины [32][33]. Например, терапия лимфогранулематоза вызывает стойкую менопаузу у 38-57 % пациентов, а в группе женщин старше 35 лет химиотерапия приводит к стойким необратимым изменениям менструальной функции [33].
- Влияние химических веществ, используемых в промышленности и сельском хозяйстве. В качестве исторической справки следует упомянуть токсическое влияние на репродуктивную функцию дихлордифенилтрихлорэтана и диэтилстильбэстрола, которые по своей химической структуре являются аналогами эстрогенов. Эти компоненты оказывают влияние на плод женского пола ещё внутриутробно [30].
- Эпидемический паротит (свинка). Есть предположение, что девочки, переболевшие свинкой, параллельно бессимптомно перенесли воспаление яичников, что способствовало ускоренной гибели фолликулов.
Классификация и стадии развития снижения овариального резерва
Общепринятой классификации не существует. На данный момент в большей степени исследуются практические аспекты решения проблемы — получения достаточного количества ооцитов при проведении стимулирующей терапии. Именно в этом ракурсе последние десятилетия предпринимались попытки ввести диагностические критерии. Одной из основных проблем при сравнении этих исследований было отсутствие единого определения, так называемого "плохого ответа". Значительные различия в определении критериев сделали практически невозможным разработку или оценку какого-либо протокола или метода лечения [34][35].
С этой целью рабочая группа Европейского общества репродукции человека и эмбриологии (ESHRE) попыталась стандартизировать определение "плохого ответа" для стимуляции женщин со сниженным овариальным резервом (Болонский консенсус) [36]. Для прогнозирования "плохого ответа" Болонский консенсус рекомендует учитывать наличие как минимум двух из нижеперечисленных условий:
- старший репродуктивный возраст женщины (35 лет и выше);
- наличие слабого ответа (три и менее) в предшествующих обычных протоколах стимуляции;
- снижение любого из диагностических критериев — количество антральных фолликулов (КАФ) менее 5-7 или уровень антимюллерового гормона (АМГ) ниже 0,5-1,1 нг/мл (3,57-7,85 пмоль/л).
Два любых эпизода "плохого ответа" после максимальной стимуляции считаются достаточными для определения пациента как "слабого ответчика". Консенсус позволил внести ясность не только в формулировку сниженного овариального резерва, но и определил прогностические критерии для планирования стимулирующей терапии [36].
С накоплением данных стало понятно, что в группу пациентов со сниженным овариальным резервом, а как следствие с неадекватным ответом на стимулирующую терапию, включены женщины с разными причинами возникновения и механизмами развития патологии. Это затрудняло планирование адекватной терапии. В связи с этим в 2016 году была сформирована рабочая группа POSEIDON ( Patient-Oriented Strategies Encompassing Individualize Oocyte Number)[37] по разработке новых критериев и классификации пациентов со сниженным овариальным резервом и бедным ответом яичников на стимуляцию.
Стимуляция овуляции
Чтобы представить более детальную картину, были предложены клинически значимые критерии, которые могут помочь врачу в ведении пациентов. Для определения групп с низким прогнозом на стимуляцию предложены две новые категории [37]:
Первая группа включает количество получаемых при стимуляции ооцитов:
- "субоптимальный ответ" — получение от четырёх до девяти ооцитов в любом возрасте связано со значительно более низкой частотой живорождений по сравнению с пациентами, у которых получено 10-15 ооцитов [38];
- "гипореагирование" — для получения адекватного количества ооцитов (более трёх) требуется более высокая доза гонадотропинов и более продолжительная стимуляция [39].
Вторая группа объединяет "качественные" и "количественные" параметры, а именно:
- возраст пациента и ожидаемая частота анеуплоидии;
- биомаркеры и функциональные маркеры — АМГ и количество антральных фолликулов (их размер достигает 2-10 мм, можно увидеть на УЗИ).
В результате введения этих категорий выделяют четыре группы пациентов со сниженным овариальным резервом и низким ответом на стимулирующую терапию:
- Первая группа:
- возраст до 35 лет;
- количество антральных фолликулов (КАФ) более 5;
- АМГ более или равно 1,2 нг/мл.
- Вторая группа:
- возраст более 35 лет;
- КАФ более 5;
- АМГ более или равно 1,2 нг/мл;
- неожиданно бедный ответ при стандартной стимуляции в ЭКО.
- Третья группа:
- возраст до 35 лет;
- КАФ менее 5;
- АМГ менее 1,2 нг/мл.
- Четвёртая группа:
- возраст более 35 лет;
- КАФ менее 5;
- АМГ менее 1,2 нг/мл.
- ожидаемо бедный ответ.
Выделение отдельных групп решает практическую задачу — планирование терапии с учётом детальных критериев для пациентов разных этиопатогенетических групп.
Осложнения снижения овариального резерва
Основное осложнение — бесплодие [52]. В результате резкого снижения количества фолликулов часть циклов проходит без овуляции. Бесплодие при СОР неизлечимо, возможны лишь варианты преодоления проблемы. Чаще всего при отсутствии результатов в программах ЭКО с использованием собственных ооцитов, альтернативным решением является применение донорских яйцеклеток, что вряд ли можно назвать лечением в привычном понимании.
Вторым по значимости осложнением является преждевременное истощение яичников и, как следствие, нарушение менструальной функции вплоть до её полного угасания. Снижение овариального резерва приводит к критическому снижению количества ооцитов и нарушение менструального цикла по типу:
- пройоменореи — сокращение цикла до менее 24 дней;
- гипоменореи — скудные месячные;
- спаниоменореей — сокращение количества менструальных циклов;
- аменореи — отсутствие менструальных выделений.
По мере снижения уровня эстрогенов появляются вегетативные симптомы: приливы, потливость, тахикардия. Пациенты жалуются на нарушения сна, эмоциональную неустойчивость, частую смену настроения и другие признаки приближения менопаузы [54].
Угасание овариальной функции влияет и на состояние других органов и систем организма. Начинает страдать опорно-двигательный аппарат — за счёт снижения уровня эстрогенов в крови нарушается электролитный баланс организма и начинается "вымывание" электролитов, что проявляется повышенной хрупкостью костей. Также может страдать сердечно-сосудистая система [53].
Диагностика снижения овариального резерва
Диагностика строится на совокупности анамнестических и клинико-лабораторных данных. Наиболее важным является возраст. Клинические проявления снижения овариального резерва зачастую начинают проявляться после 35 лет.
Очень часто в анамнезе есть упоминания о раннем наступлении климакса у ближайших родственников по женской линии (мать, старшие сестры).
Основными жалобами являются нарушение (чаще сокращение продолжительности и интенсивности) менструального цикла и бесплодие.
Из объективных критериев:
- достоверное повышение уровня фолликулостимулирующего гормона (ФСГ) до 40 МЕ/л [14][18][40];
- снижение уровня антимюллерового гормона (АМГ) менее 1,2 нг/мл [37];
- при ультразвуковом исследовании — снижение количества антральных фолликулов (КАФ) [37].
Из вышеперечисленных критериев на сегодняшний день наиболее информативным критерием для постановки диагноза СОР является определение АМГ [41][42]. Концентрация АМГ более связана с количеством антральных фолликулов, определяемом при проведении ультразвукового исследования, чем с ранее используемыми критериями концентрации ФСГ или Ингибина B (гликопротеина, который синтезируется в фолликулах яичников) [43][44]. Ценность определения антимюллерового гормона заключается в его низкой вариабельности от цикла к циклу [45].
Лечение снижения овариального резерва
Патогенетического лечения не существует. Терапия направлена прежде всего на устранение последствий снижения овариального резерва, а именно преодоления бесплодия.
В программах вспомогательной репродукции в зависимости от принадлежности пациентки к той или иной группе по критериям POSEIDON рассматриваются различные стратегии стимулирующей терапии для получения большего количества ооцитов.
Для первой и второй групп применяется пять основных стратегий отдельно или в комбинациях:
- приоритет в использования рекомбинантного ФСГ (фолликулостимулирующего гормона) по сравнению с гонадотропинами, получаемыми из мочи;
- увеличение разовой и суммарной дозы ФСГ для проведения стимуляции;
- использование рекомбинантного ЛГ (лютеинизирующего гормона);
- добавление стероидного гормона дегидроэпиандростерона (DHEA) перед овариальной стимуляцией;
- применение протокола двойной стимуляции (DuoStim) [46].
Наиболее сложными с позиции получения достаточного количества ооцитов по критериям POSEIDON являются пациентки, относящиеся к третьей и четвёртой группам .
Стратегии, предложенные для стимуляции пациенток третьей и четвёртой групп:
- применение индивидуальных протоколов стимуляции — минимальная, низкодозная стимуляция, натуральный цикл (получение яйцеклеток без проведения стимуляции яичников) [47][48];
- индивидуальная стратегия триггера овуляции (им может быть, например хорионический гонадотропин человека или агонист гонадотропин-рилизинг гормона);
- применение адъювантной (дополнительной) предварительной терапии [46].
Несмотря на активное применение низкодозовых протоколов, исследования последних лет поддерживают идеи стимуляции высокими дозами рекомбинантного ФСГ с добавлением рекомбинантного ЛГ [46].
При невозможности получения достаточного количества ооцитов рекомендовано использование донорских ооцитов.
Использование донорских ооцитов
Прогноз. Профилактика
Прогноз для жизни благоприятный. При критическом снижении овариального резерва и наступлении климактерических изменений необходимо применять заместительную гормональную терапию. Её проводят для предотвращения осложнений опорно-двигательной системы (остеопороза), нарушений электролитного баланса организма и "вымывания" электролитов, развития болезней сердечно-сосудистой системы [53].
Для профилактики бесплодия рекомендовано:
- планировать и реализовать репродуктивную функцию до 35 лет, особенно женщинам, находящимся в группе риска (ранняя менопауза у матери, эндометриоз, оперативные вмешательства на яичниках);
- исключить вредные привычки (курение, употребление алкоголя);
- банкинг ооцитов или эмбрионов в случае, если беременность и роды не планируются до 35 лет, или перед предстоящей химио- и/или лучевой терапией при лечении онкологических заболеваний.
Профилактика ятрогенных осложнений:
- сократить оперативные вмешательства в случаях, когда возможно применить консервативную терапию;
- при необходимости операции на яичниках максимально бережно относиться к овариальной ткани [55].
Список литературы
Международная Классификации Болезней 10-й редакции на сайте ВОЗ. ссылка
Testing and interpreting measures of ovarian reserve: a committee opinion. Practice committee of the American society for reproductive medicine // Fertil Steril, 2015; 103 (3): 9-17. ссылка
Committee opinion no. 618: ovarian reserve testing // Obstet Gynecol, 2015; 125 (1): 268-273.ссылка
Денисенко М. В., Курцер М. А., Курило Л. Ф. Овариальный резерв и методы его оценки // Вопросы гинекологии, акушерства и перинатологии, 2016; 15 (3): 41-47.
Кавтеладзе Е. В., Соломатина А. А., Сафронова Д. А., Смирнова А. А., Тюменцева М. Ю. Овариальный резерв и функциональное состояние яичников при эндометриозе до и после оперативного вмешательства // Вестник Российского государственного медицинского университета, 2011; 2:73-77.
Гаспаров А. С., Дубинская Е. Д., Титов Д. С. Клиническое значение овариального резерва в реализации репродуктивной функции // Акушерство и гинекология, 2014; 4:11-16.
Findlay J. K, Hutt K. J., Hickey M., Anderson R. A. What is the “ovarian reserve”? // Fertil Steril, 2015; 103 (3): 628-630.ссылка
Ramalho de Carvalho B., Gomes Sobrinho D. B., Vieira A. D, Barbosa A. C., Silva A. A., Nakagava H. M. Ovarian reserve assessment for infertility investigation // ISRN Obstet Gynecol, 2012: 576385.ссылка
Fleming R., Seifer D. B., Frattarelli J. L., Ruman J. Assessing ovarian response: antral follicle count versus anti-müllerian hormone // Reprod Biomed Online, 2015; 31 (4): 486-496.ссылка
Wallace W. H., Kelsey T. W. Human ovarian reserve from conception to menopause // PLoS One, 2010; 5: e8772.ссылка
Baker T. G. Radiosensitivity of mammalian oocytes with particular reference to the human female // Am J Obstet Gynecol, 1971; 110: 746–761.ссылка
Ramalho de Carvalho B., Gomes Sobrinho D. B., Vieira A. D., Barbosa A. C., Silva A. A., Nakagava H. M. Ovarian reserve assessment for infertility investigation // ISRN Obstet Gynecol, 2012.ссылка
Кельмансон И. А. Перинатология и перинатальная психология. — СПб.: СпецЛит., 2015.
Овариальный резерв и фертильность: сложности XXI века. Рациональный подход к сохранению репродуктивного резерва как залог фертильности и осознанного деторождения. Информационное письмо. Под ред. Радзинского В.Е. — М.: Status Praesens, 2015.
Amanvermez R., Tosun M. An update on ovarian aging and ovarian reserve tests // Int J Fertil Steril, 2016; 9 (4): 411-415.ссылка
Jirge P. R. Poor ovarian reserve // J Hum Reprod Sci, 2016; 9 (2): 63-69.ссылка
Hewlett M., Mahalingaiah S. Update on primary ovarian i ciency // Curr Opin Endocrinol Diabetes Obes, 2015; 22 (6): 483-489.ссылка
Barasoain M, Barrenetxea G, Huerta I, Télez M, Criado B, Arrieta I. Study of the genetic etiology of primary ovarian insufficiency: FMR1 Gene. Genes (Basel), 2016; 7(12).ссылка
The ESHRE Guideline Group on POI, Webber L., Davies M., Anderson R., Bartlett J., Braat D., Cartwright B., Cifkova R., de Muinck Keizer-Schrama S., Hogervorst E., Janse F., Liao L., Vlaisavljevic V., Zillikens C., Vermeulen N. ESHRE Guideline: management of women with premature ovarian insufficiency. // Hum Reprod, 2016; 31 (5): 926-937.ссылка
Щербина Н. А., Градиль О. Г. Оценка возрастных изменений овариального резерва у женщин с бесплодием // Таврический медико-биологический вестник, 2013; 16 (2): 140-144.
Гурьева В. А., Куракина В. А. Оценка факторов, определяющих овариальный резерв у женщин с нарушенной репродуктивной функцией // Журнал акушерства и женских болезней, 2012; 61 (6): 76-81.
Еренкова С. Е., Бейсембаева М. К., Муртаева Д. А., Гусенова Р. И., Кемелбекова А. А., Даулетбаева Ж. Б., Мирзахметова Н. Х. Состояние яичников после оперативных вмешательств на органах малого таза у женщин репродуктивного возраста // Вестник КазНМУ, 2014; 3(3): 65-68.
Куприянова И. И., Петров И. А., Тихоновская О. А. Состояние овариального резерва после операций на маточных трубах // Современные проблемы науки и образования, 2015; 6:71-76.
Гасымова У. Р., Соснова Е. А., Грачев Г. А. Последствия оперативных вмешательств на органах малого таза у женщин репродуктивного возраста. Проблемы женского здоровья, 2012; 7( 3): 56-60.
Ye X., Yang Y., Sun X. A retrospective analysis of the effect of s gectomy on serum anti-müllerian hormone level and ovarian reserve // Am J Obstet Gynecol, 2015; 212:53.ссылка
Grynnerup A. G, Lindhard A., Sørensen S. Anti-müllerian hormone levels in salpingectomized compared with nonsalpingectomized women with tubal factor infertility and women with unexplained infertility // Acta Obstet Gynecol Scand, 2013; 92: 1297-1303.ссылка
Fuentes A., Munoz A., Pommer R., Arguello B., Galleguillos A., Jesam C. Decreased anti-müllerian hormone concentration in follicular fluid of female smokers undergoing artificial reproductive techniques // Chemosphere, 2012; 88 (4): 403-406.ссылка
Fuentes A., Escalona J., Céspedes P., Repetto V., Iñiguez G. Effects of smoking on plasma antimüllerian hormone concentrations among infertile women // Rev Med Chil, 2013; 141 (1): 23-27.ссылка
Hawkins Bressler L., Bernardi L. A., De Chavez P. J., Baird D. D. Alcohol, cigarette smoking, and ovarian reserve in reproductive-age African-American women // Am J Obstet Gynecol, 2016; 215 (6): 758.ссылка
Wise L. A., Troisi R., Hatch E. E., Titus L. J., Rothman K. J., Harlow B. L. Prenatal diethylstilbestrol exposure and reproductive hormones in premenopausal // J Dev Orig Health Dis, 2015; 3 (6): 208-216.ссылка
Behringer K., Mueller H., Goergen H., Thielen I., Eibl A. D., Stumpf V., Wessels C., Wiehlputz M., Rosenbrock J., Halbsguth T., Reiners K. S., Schober T., Renno J. H., von Wolf M., van der Ven K., Kuehr M., Fuchs M., Diehl V., Engert A., Borchmann P. Gonadal function and fertility in survivors after Hodgkin lymphoma treatment within the German Hodgkin Study Group HD13 to HD15 trials // J Clin Oncol, 2013; 31: 231-239.ссылка
Кокаева Л. Э., Троик Е. Б., Сергеева И. В., Шнейдер Т. В. Состояние репродуктивного здоровья у больных с лимфомами Ходжкина // СИСП, 2012; 9 (17): 92.
Surrey E. S., Schoolcraft W. B. Evaluating strategies for improving ovarian response of the poor responder undergoing assisted reproductive techniques. Fertil Steril, 2000; 73: 667–676.ссылка
Polyzos N. P., Devroey P. A. Systematic review of randomized trials for the treatment of poor ovarian responders: Is there any light at the end of the tunnel? // Fertil Steril, 2011; 96: 1058–1061.ссылка
Ferraretti A. P, La Marca A., Fauser B. C, Tarlatzis B., Nargund G., Gianaroli L. ESHRE consensus on the definition of “poor response” to ovarian stimulation for in vitro fertilization: The Bologna criteria // Hum Reprod, 2011; 26: 1616–1624ссылка
Alviggi C., Andersen C. Y., Buehler K., Conforti A., De Placido G., Esteves S. C., Fischer R., Galliano D., Polyzos N. P., Sunkara S. K., Ubaldi F. M., Humaidan P. A new more detailed stratification of low responders to ovarian stimulation: from a poor ovarian response to a low prognosis concept // Fertil Steril, 2016; 105 (6): 1452-1453. ссылка
Drakopoulos P., Blockeel C., Stoop D., Camus M., de Vos M., Tournaye H., Polyzos N. P. Conventional ovarian stimulation and single embryo transfer for IVF/ ICSI. How many oocytes do we need to maximize cumulative live birth rates after utilization of all fresh and frozen embryos? // Hum Reprod, 2016; 31: 370–376.ссылка
Alviggi C., Pettersson K., Longobardi S., Andersen C. Y., Conforti A., De Rosa P., et al. A common polymorphic allele of the LH beta-subunit gene is associated with higher exogenous FSH consumption during controlled ovarian stimulation for assisted reproductive technology // Reprod Biol Endocrinol, 2013; 1:51.
Cox L., Liu J. H. Primary ovarian insufficiency: an update // Int J Womens Health, 2014; 6:235.ссылка
Nelson S. M. Biomarkers of ovarian response: current and future applications // Fertil Steril, 2013; 99: 963-969.ссылка
Majumder K., Gelbaya T. A., Laing I., Nardo L. G. The use of anti-Mullerian hormone and antral follicle count to predict the potential of oocytes and embryos // Eur J Obstet Gynecol Reprod Biol, 2010; 150: 166-170.ссылка
La Marca A., Sighinolfi G., Radi D., Argento C., Baraldi E., Artenisio A. C., Stabile G., Volpe A. Anti-Mullerian hormone (AMH) as a predictive marker in assisted reproductive technology (ART) // Hum Reprod Update, 2010; 16: 113-130.ссылка
Van Disseldorp J., Lambalk C. B., Kwee J., Looman C. W., Eijkemans M. J., Fauser B. C., Broekmans F. J. Comparison of inter- and intra-cycle variability of anti-Mullerian hormone and antral follicle counts // Hum Reprod, 2010; 25: 221-227.ссылка
Abu-Musa A., Haahr T., Humaidan P. Novel Physiology and Definition of Poor Ovarian Response; Clinical Recommendations // Int J Mol Sci, 2020; 21 (6): 2110. ссылка
Kim C. H., Kim S. R., Cheon Y. P., Kim S. H., Chae H .D., Kang B. M. Minimal stimulation using gonadotropin-releasing hormone (GnRH) antagonist and recombinant human follicle-stimulating hormone versus GnRH antagonist multiple-dose protocol in low responders undergoing in vitro fertilization/intracytoplasmic sperm injection // Fertil. Steril, 2009: 92. ссылка
Morgia F., Sbracia M., Schimberni M., Giallonardo A., Piscitelli C., Giannini P., Giannini P., Aragona C. A controlled trial of natural cycle versus microdose gonadotropin-releasing hormone analog flare cycles in poor responders undergoing in vitro fertilization // Fertil. Steril, 2004; 81: 1542–1547.ссылка
Sunkara S. K., Coomarasamy A., Faris R., Braude P., Khalaf Y. Long gonadotropin-releasing hormone agonist versus short agonist versus antagonist regimens in poor responders undergoing in vitro fertilization: A randomized controlled trial // Fertil. Steril, 2014.ссылка
Franasiak J. M., Forman E. J., Hong K. H., et al. The nature of aneuploidy with increasing age of the female partner: a review of 15,169 consecutive trophectoderm biopsies evaluated with comprehensive chromosomal screening // Fertil Steril, 2014; 101 (3): 656‐663.ссылка
Faddy M., Gosden R. A mathematical model of follicle dynamics in the human ovary // Hum. Repr., 1995; Vol. 10: 770–775.ссылка
Мишиева Н. Г. Бесплодие у женщин позднего репродуктивного возраста: принципы диагностики и лечения в зависимости от овариального резерва: Автореф. дисс. … докт. мед. наук. — М., 2008.
Аничков, Д. А., Шостак, Н. А., Журавлева, А. Д. Менопауза и сердечно-сосудистый риск // Рациональная фармакотерапия в кардиологии, 2005; 1 (1): 37-42.
Бобылева И. В. Характер обменно-эндокринных нарушений у женщин при естественной и хирургической менопаузе // Бюллетень медицинских интернет-конференций, 2015; 5 (4): 219-221.
Боярский К. Ю., Гайдуков С. Н., Чинчаладзе А. С. Факторы, определяющие овариальный резерв женщины // Журнал акушерства и женских болезней, 2009; 65-71.

